Questões de Vestibular de Química - Equilíbrio Químico
Foram encontradas 633 questões
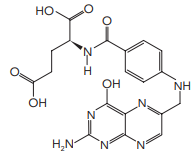
Considere um dado valor de pH, para o qual apenas os hidrogênios das carboxilas do ácido fólico se ionizam. Nessa situação, a carga do ânion formado é igual a:
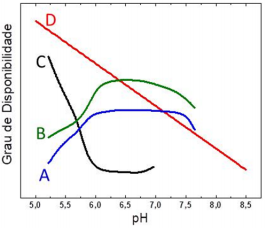
Considerando essas informações e os conhecimentos de química, é correto afirmar que a calagem atua em solos
Considere que uma colher de sopa de vinagre com um teor de ácido acético de 3,0 % (m/v) foi misturada com 4 colheres de sopa de água para ser usada em limpeza. O valor de pH do vinagre após a diluição é de:
Considere um frasco de contraste contendo 100 mL de suspensão de sulfato de bário na presença de sulfato de potássio 0,01 mol.L-1. A massa de bário presente na forma de íons Ba2+ na suspensão está na ordem de:
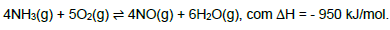
Quando a reação atinge o equilíbrio, uma maneira de aumentar a produção de NO(g) é aumentando a(o):