Questões de Química - Transformações Químicas e Energia para Concurso
Foram encontradas 1.256 questões
Julgue o seguinte item, em relação à eletroquímica.
Considerando-se os potenciais de redução 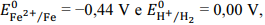 é correto afirmar que
um prego de ferro colocado em uma solução de HCl 1 mol/L
permanece em seu estado inalterado.
é correto afirmar que
um prego de ferro colocado em uma solução de HCl 1 mol/L
permanece em seu estado inalterado.
Segundo a IUPAC, a dupla barra vertical na notação das pilhas eletroquímicas representa a ponte salina.
A Lei de Faraday da eletrólise enuncia que “a quantidade do produto formado ou do reagente consumido por uma corrente elétrica é estequiometricamente equivalente à quantidade de elétrons fornecidos”. Pode-se afirmar, portanto, que a quantidade (em mols) de Al(s) que pode ser produzida a partir do alumínio no composto Al2O3, se 5 mols de elétrons forem fornecidos, é aproximadamente:
(ATKINS; JONES, Princípios de Química: questionando a vida moderna e o meio ambiente, Editora Bookman, 2006)
“A energia livre de Gibbs é uma grandeza termodinâmica notável”. A entropia é considerada uma função de estado assim como a entalpia. Considerando a síntese da amônia a partir de N2(g) e H2(g) a 298 K conforme equação a seguir:
(BROWN; LEMAY; BURSTEN, Química: a ciência central, São Paulo: Pearson Prentice Hall, 2005, p. 702)
N2(g) + 3 H2(g) → 2 NH3(g)
E conhecendo as informações do quadro abaixo:
Substância |
ΔHºf(kJ.mol-1) |
Sº (J.mol-1.k-1) |
N2(g) |
0 |
191,5 |
H2(g) |
0 |
130,6 |
NH3(g) |
–80,3 |
111,3 |
Podemos afirmar, com base nos dados apresentados, que o valor da variação da energia livre de Gibbs para a síntese da amônia, em kJ.mol-1, é aproximadamente:
A teoria de Arrhenius para ácidos e bases é baseada da dissociação eletrolítica dos íons hidrogênio e hidroxila em meio aquoso. No entendimento de Arrhenius, as bases são compostos que, quando dissolvidos em água, aumentam a concentração de íons OH-. Essa teoria/definição explica apenas alguns fenômenos básicos (quando dissolvidos em água), porém não explica quando envolvidas substâncias em soluções não aquosas. De acordo com a teoria mais abrangente existente, as bases são compostos que doam um par de elétrons. Qual/is foi/foram o(s) cientista(s) proponente(s) de tal definição?
(BROWN, Theodore L. Química, a ciência central. São Paulo: Prentice Hall, 2005)