Questões de Vestibular de Química - Equilíbrio Químico
Foram encontradas 632 questões
(Disponível em:<http://www.usp.br/qambiental/chuva_acidafront.html#formacao>. Acesso em: 07 de nov. 2018. Adaptado).
Esse processo pode ser descrito por:
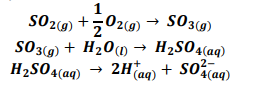
Uma amostra de chuva, contendo exclusivamente ácido sulfúrico (a = 100%), mostrou uma concentração de 5.10-5 mol /L.
O pH da referida chuva é de:
DADOS QUE PODEM SER USADOS NESTA PROVA

DADOS QUE PODEM SER USADOS NESTA PROVA

H2(g) + Cℓ2(g) ↔ 2HCℓ(g)
Supondo que em um recipiente fechado de 2,00 L de capacidade encontram-se 8,00 g de H2, 71,00 g de Cℓ2 e 146,00 g de HCℓ, assinale a alternativa que apresenta, corretamente, o valor da constante de equilíbrio em termos de concentração (Kc).
Dados: H = 1; Cℓ = 35,5