Questões de Vestibular de Química - Sistemas Homogêneos: Equilíbrio Químico na Água: pH e pOH, Indicadores Ácido-Base, Solução Tampão.
Foram encontradas 329 questões
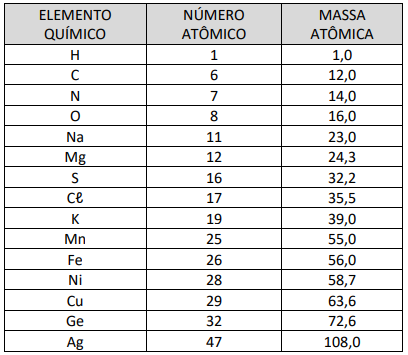
1) Dissolveu-se uma pastilha de permanganato de potássio (KMnO4) em um becker contendo 40mL de água destilada, com formação da cor violeta. 2) A seguir, adicionou-se neste becker, 20mL de vinagre incolor, permanecendo a cor violeta. 3) Neste mesmo becker, adicionou-se 20mL de água oxigenada, H2O2 (10 vol.), e imediatamente a cor violeta desapareceu, ficando incolor. 4) Em outro becker, repetiu-se a etapa 1 desse procedimento, e logo a seguir adicionou-se 20mL de água oxigenada (10 vol.), ocorrendo a mudança da cor violeta para marrom.
Com relação a essa experiência, assinale a alternativa correta.
Com base no texto anterior e nas informações precedentes e considerando que 1 L = 1 dm3 , julgue o item.
A primeira constante de dissociação ácida do ácido cítrico
(Ka1) é superior a 10−3.