Questões de Concurso
Foram encontradas 1.417 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Com relação aos processos termodinâmicos que envolvem liberação e aproveitamento de energia, julgue o item que se segue.
O rendimento de uma máquina térmica que obedece ao ciclo
de Carnot depende exclusivamente das temperaturas da fonte
fria e da fonte quente.
Com relação aos processos termodinâmicos que envolvem liberação e aproveitamento de energia, julgue o item que se segue.
No cálculo do consumo mínimo mássico de oxigênio na
combustão de um combustível que contém C, H, S etc.,
devem ser consideradas as reações de combustão de cada um
dos elementos presentes. No caso de um combustível que
contém apenas C, H e S, o hidrogênio é o elemento que
requer mais massa de oxigênio na combustão.
Com relação aos processos termodinâmicos que envolvem liberação e aproveitamento de energia, julgue o item que se segue.
O poder calorífico de um combustível não pode ser calculado
a partir dos poderes caloríficos de seus componentes.
Com relação aos processos termodinâmicos que envolvem liberação e aproveitamento de energia, julgue o item que se segue.
O calor desprendido em uma reação química é quantificado
pela entalpia de reação, cujo valor independe da temperatura
de reação.
Com relação aos processos termodinâmicos que envolvem liberação e aproveitamento de energia, julgue o item que se segue.
Em um processo termodinâmico cíclico, isto é, que se
origina e termina em um mesmo estado, a variação da
energia interna é nula.
Com relação a gases reais e a desvio da idealidade, julgue o item a seguir.
Na equação do virial, usada na mistura de gases reais, os
coeficientes dependem exclusivamente da temperatura.
A Demanda Bioquímica de Oxigênio (DBO5) é um teste empírico em que é determinado o requerimento relativo de oxigênio por microrganismos decompositores da matéria orgânica, em águas de efluentes e águas poluídas. Sobre os procedimentos de amostragem e análise desse método analítico são feitas as seguintes afirmativas.
I. A incubação é realizada em um ambiente com temperatura controlada á 20°C e luz incidente sobre o frasco contendo a amostra.
II. É recomendado, para efluentes ricos em matéria orgânica, não tratados e da DBO5 desconhecida, num primeiro teste, que a amostra seja submetida a mais de uma diluição simultânea.
III. Amostras contendo alto teor de cloro podem apresentar resultados superestimados de DBO5 em relação à realidade ambiental.
IV. Esgotos domésticos ricos em matéria orgânica, embora completamente anóxicos, são inviáveis à analise da DBO5.
V. O pH ideal para as reações de oxidação é acima de 8,5.
Assinale a alternativa que apresenta a(s) afirmativa(s) correta(s).
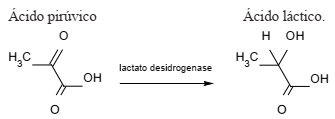
Sobre essa reação, pode-se afirmar que:
A Lei 11.445 de 05 de janeiro de 2007, estabeleceu diretrizes nacionais para o saneamento básico, e determina que os municípios elaborem seus planos de saneamento, dentro de uma visão integrada com a participação da sociedade. Assinale a informação INCORRETA sobre os princípios que devem ser seguidos segundo essa lei:
I. Existem estados particulares, chamados estados de equilíbrio, de sistemas simples os quais, macroscopicamente, são completamente caracterizados pela energia interna, U, o volume, V, e os números de moles N1, N2, ..., Nr, de seus componentes químicos.
II. Existe uma função, chamada entropia, S, dos parâmetros extensivos de qualquer sistema composto, definida para todos os estados de equilíbrio, possuindo a seguinte propriedade: os valores assumidos pelos parâmetros extensivos na ausência de uma restrição interna são aqueles que maximizam a entropia sobre o conjunto de estados de equilíbrio sob restrição.
III. A entropia de um sistema composto é aditiva sobre os subsistemas constituintes. A entropia é uma função descontínua e diferençável, e monotonicamente crescente da energia interna.
Assinale a alternativa correta:
Considere, em um sistema ideal, que uma chaminé recebeu 2,4 x 1019 moléculas de SO2 que foram misturadas com 10 g do carbonato de cálcio. Nessas condições, quantos miligramas, aproximadamente, de sulfato de cálcio ficariam retidos na chaminé?
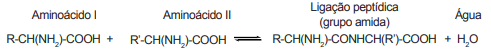 Considere que 2 mols de molécula do aminoácido I são adicionados para reagir com 1 mol de molécula do aminoácido II.
Quando o equilíbrio químico é estabelecido (equilíbrio 1), 20% do aminoácido I é consumido. Em seguida, adicionou-se
certa quantidade de mols de molécula do aminoácido II, e 10% do aminoácido I foi consumido até reestabelecer um novo
equilíbrio (equilíbrio 2).
Nessas condições, qual é a razão aproximada entre o primeiro e segundo equilíbrios?
Considere que 2 mols de molécula do aminoácido I são adicionados para reagir com 1 mol de molécula do aminoácido II.
Quando o equilíbrio químico é estabelecido (equilíbrio 1), 20% do aminoácido I é consumido. Em seguida, adicionou-se
certa quantidade de mols de molécula do aminoácido II, e 10% do aminoácido I foi consumido até reestabelecer um novo
equilíbrio (equilíbrio 2).
Nessas condições, qual é a razão aproximada entre o primeiro e segundo equilíbrios?2H2 (g) + 2NO (g) → N2(g) + 2H2O (g)
Para compreender a velocidade da reação química em função das concentrações dos reagentes, um técnico realizou os seguintes experimentos.
Experimento 1 – Quando dobrou a concentração do gás hidrogênio e reduziu à metade a concentração do óxido nítrico, a velocidade da reação dobrou.
Experimento 2 – Quando quadruplicou a concentração do gás hidrogênio e dobrou a concentração do óxido nítrico, a velocidade da reação química quadruplicou.
A partir dessas informações, é correto afirmar que a expressão matemática da Lei de Velocidade é representada por:
C6 H12O6 (s) + 6O2 (g) → 6CO2 (g) + 6H2O (g)
Nessas condições, e considerando que os gases são ideais, é correto afirmar que a variação de entalpia da mesma reação é, em quilojoules, aproximadamente igual a:
Dado: Constante dos gases (R) = 8,31 JK–1mol–1
Sendo assim, os reatores
