Questões de Química - Sistemas Homogêneos: Constantes: Kc e Kp. Deslocamento do Equilíbrio: Fatores. para Concurso
Foram encontradas 242 questões
Considere-se que, processando-se a reação I em um recipiente fechado de 2 L na temperatura T1, o equilíbrio tenha sido atingido com 1 × 10−2 mol de A2, 2 × 10−2 mol de B2 e 4 × 10−2 mol de AB. Assim, caso a temperatura seja alterada para T2, na qual a constante de equilíbrio seja igual a 40, é correto afirmar que, a partir da condição de equilíbrio anterior, a reação favorecida será a inversa, no sentido da formação dos reagentes A2 e B2.
A relação entre as duas constantes de equilíbrio é K2= K1−2.
O ácido fosfórico é um reagente amplamente utilizado nas indústrias alimentícias, têxtil e metalúrgica. Na fabricação de fertilizantes, o H3PO4 também é frequentemente empregado na produção de superfosfatos. Em laboratórios de análises químicas, o H3PO4 é frequentemente utilizado para o preparo de soluções aquosas destinadas à realização de um grande número de procedimentos. Esse ácido se dissocia em água de acordo com as seguintes reações de hidrólise:
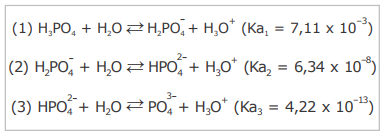
A partir das reações demonstradas acima, considere as seguintes afirmativas.
I - A partir da dissociação do H3PO4, três bases conjugadas são formadas na solução em equilíbrio químico.
II - A etapa (3) de dissociação libera a maior concentração de íons hidrônio (H3O+) na solução em equilíbrio químico.
III - A concentração do ânion 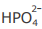 é maior que a concentração do ânion
é maior que a concentração do ânion 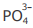 na solução em equilíbrio 4
químico.
na solução em equilíbrio 4
químico.
IV - A concentração do ânion 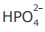 é maior que a concentração do ânion
é maior que a concentração do ânion 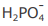 na solução em equilíbrio químico.
na solução em equilíbrio químico.
Estão corretas