Segundo KATZUNG, B.G. et al. (2017), Uma porcentagem muito g...
Segundo KATZUNG, B.G. et al. (2017), Uma porcentagem muito grande dos fármacos em uso é de ácidos fracos ou bases fracas.
A equação de Henderson-Hasselbalch correlaciona a razão ácido fraco ou base fraca nas formas protonada e não protonada, ao pKa da molécula e ao pH do meio:
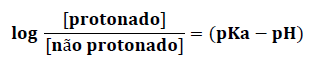
A equação acima se aplica tanto a fármacos ácidos como alcalinos.
O percentual de ionização de ácidos e bases fracas pode ser calculado pelas seguintes equações:

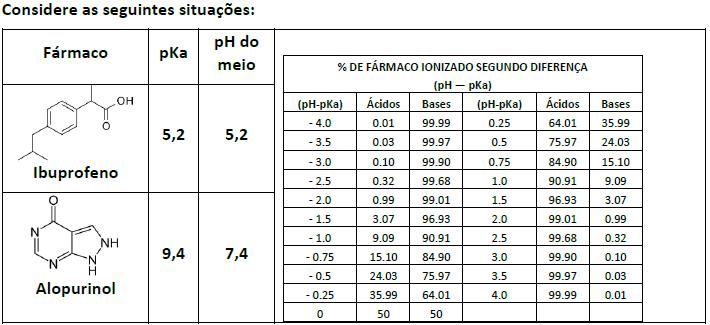
Com base nas informações acima, analise as seguintes afirmativas:
I. A carga eletrostática de uma molécula ionizada atrai dipolos de água e resulta em um complexo polar, relativamente hidrossolúvel e insolúvel em lipídeos. Como a difusão lipídica depende de solubilidade lipídica relativamente alta, a ionização de fármacos pode reduzir bastante sua capacidade de permear membranas. Assim, quanto mais baixo o pH do meio em relação ao pKa, maior será a fração do fármaco na forma não protonada.
II. A forma sem carga é a mais lipossolúvel, e, portanto a maior parte de um ácido fraco estará na forma lipossolúvel em pH ácido.
III. Em pH 5,2, o Ibuprofeno encontra-se 50% na forma protonada. Já o Alopurinol encontra-se > 99% na sua forma não protonada no meio de pH 7,4.
Assinale a opção que corresponde corretamente as afirmativas acima como sendo Verdadeira
(V) ou Falsa (F):