Questões de Vestibular de Química - Soluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais.
Foram encontradas 457 questões
O texto abaixo está presente na legislação que institui o Código de Trânsito Brasileiro- CTB.
“[...]Conduzir veículo automotor, na via pública, estando com concentração de álcool por litro de sangue igual ou superior a 6 (seis) decigramas, ou sob a influência de qualquer outra substância psicoativa que determine dependência: Penas - detenção, de seis meses a três anos, multa e suspensão ou proibição de se obter a permissão ou a habilitação para dirigir veículo automotor. [...]”
Um condutor automotivo parado em uma operação policial, após ser submetido a análises técnicas, apresentou uma concentração de 21 decigramas de álcool por litro de sangue.
Com base no texto acima e nos conceitos químicos, analise as afirmações a seguir.
I- A concentração de álcool no sangue desse condutor é de 2,1μg/μL.
II- O condutor deverá ser penalizado segundo a legislação do CTB.
III- Caso o condutor possua em seu organismo um volume de sangue igual a 5,0 L, a quantidade de álcool presente em seu corpo é de 10,5 g.
IV - A combustão completa do etanol geral CO e água.
Assinale a alternativa correta.
As reações envolvidas no processo são:
C8O2H7CO2H (aq) + NaOH (aq) → C8O2H7CO2Na (aq) + H2O (l) H2SO4 (aq) + 2 NaOH (aq) → Na2SO4 (aq) + 2 H2O (l)
Dada a massa molar do ácido acetilsalicílico = 180 g/mol.
O teor (percentual em massa) de ácido acetilsalicílico encontrado pelo estudante no comprimido de aspirina foi de
“Os íons de metais alcalinos têm importantes funções no nosso organismo, tais como influenciar em contrações musculares e pressão arterial, manter a pressão osmótica dentro das células e influenciar a condução dos impulsos nervosos. A diferença nas concentrações totais de íon de metais alcalinos dentro e fora da célula produz um potencial elétrico pela membrana celular, responsável, por exemplo, pela geração de sinais elétricos rítmicos no coração. As concentrações de Na+ e K+ nas células sanguíneas vermelhas são de 0,253 g.L−1 e de 3,588 g.L−1, respectivamente”.
Rayner-Canham, G.; Overton, T.
Química Inorgânica Descritiva. LTC.
As concentrações aproximadas desses íons, em
mol L−1, são respectivamente
Leia o texto e analise as informações sobre teor de cafeína nas amostras apresentadas a seguir.
Bebidas e alimentos contendo cafeína (C8 H10N4 O2 ) são apreciados no mundo todo, o que motiva uma extensa produção agrícola. Apesar de sua popularidade, a cafeína é considerada uma substância tóxica, podendo levar à morte se for consumida em uma dose de 10 g ou superior. No Rio Grande do Sul, o mate e o café são muito populares, mas qual deles tem a maior quantidade de cafeína? A tabela abaixo mostra a quantidade de cafeína encontrada em algumas amostras.
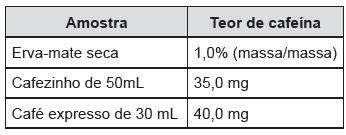
Em relação aos dados apresentados, assinale a
alternativa correta
INSTRUÇÃO: Para responder à questão, analise a representação do glifosato a seguir.
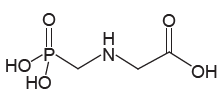
O uso de agrotóxicos é objeto de preocupações, pois o contato com doses elevadas no momento da aplicação tem causado sérios problemas de saúde a trabalhadores rurais. Esse problema se agrava quando os agricultores aplicam doses maiores do que as recomendadas, em uma tentativa de controlar pragas resistentes. O glifosato, por exemplo, no uso agrícola comum, é adquirido como uma solução com a concentração de 360 gramas por litro, sendo aplicados cinco litros por hectare (um hectare equivale a 10000 m²).
Sobre esse assunto, fazem-se as seguintes afirmativas.
I. Em uma aplicação de glifosato, cada hectare de lavoura recebe mais de 1,0×1023 moléculas desse herbicida.
II. Em uma molécula de glifosato há mais átomos de hidrogênio do que de oxigênio.
III. A concentração de glifosato na solução é de aproximadamente 2,1 mol/L.
Está/Estão correta(s) a(s) afirmativa(s)