Questões de Vestibular de Química - Grandezas: massa, volume, mol, massa molar, constante de Avogadro e Estequiometria.
Foram encontradas 624 questões
O balanceamento de equações químicas de oxirredução constitui ferramenta de grande utilidade na Química. O principal fundamento da técnica de balanceamento é o princípio de igualdade entre elétrons cedidos e recebidos, durante o processo de reação química. Considerando-se essas informações e a aplicação do princípio de balanceamento de equação química, com os menores coeficientes estequiométricos inteiros, é correto afirmar:
Considerando-se essas informações e com base nos conhecimentos sobre os conceitos de massa atômica, massa molecular e mol, é correto afirmar:
Quando zinco (Zn) metálico é colocado em contato com ácido clorídrico (HCl) ocorre uma reação de oxirredução com liberação de gás hidrogênio (H2) conforme representado pela reação a seguir:
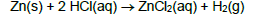
Se 10,00 g de Zn foram misturados com 8,00 g de ácido clorídrico, quantos mols de H2 foram liberados aproximadamente:
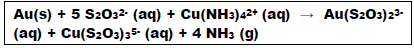
Analise as afirmativas em relação às informações:
I. Na reação demonstrada, o ouro é o agente redutor e o tiossulfato o agente oxidante.
II. É possível afirmar que são descartados anualmente 12 mil toneladas de ouro no lixo eletrônico.
III. A massa de material não metálico descartado anualmente é 1.000 vezes superior à massa de ouro descartada no mesmo período.
IV. Um volume de 14 milhões de metros cúbicos (m3 ) de materiais não metálicos são descartados anualmente no lixo eletrônico.
V. Seriam necessários 6,82 mil toneladas de tiossulfato para tratar a massa de ouro descartada no lixo eletrônico.
Assinale a alternativa CORRETA.
O dióxido de enxofre (SO2), produto da combustão do carvão em centrais termoelétricas, é o mais importante precursor da chuva ácida, ocasionando impacto nas florestas, pastos, lavouras, ambientes aquáticos e afetando o solo. Uma tecnologia de dessulfurização de gás de chaminé, para limitar a emissão de SO2, utiliza o CaCO3 como adsorvente deste gás e gera o gesso (sulfato de cálcio). Segundo dados do IPCC2006 (Intergovernmental Panel on Climate Change), no mundo, aproximadamente 1012 g de SO2 deixam de ser emitidos por ano devido à utilização de tecnologias de dessulfurização dos gases de exaustão após combustão do carvão. Considerando que toda tecnologia de dessulfurização empregue carbonato de cálcio, a massa de gesso produzida em um ano, a partir do consumo de 1012 g de SO2 , com rendimento de 100%, de acordo com a equação química a seguir, é de aproximadamente
2 CaCO3(s) + 2 SO2(g) + O2(g) → 2 CaSO4(g) + 2 CO2(g)