Questões de Vestibular de Química - Grandezas: massa, volume, mol, massa molar, constante de Avogadro e Estequiometria.
Foram encontradas 624 questões
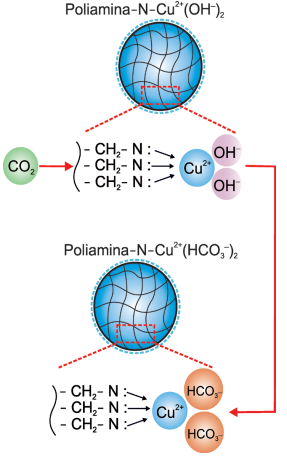
De acordo com os autores do estudo, 1 kg de poliamina contendo cobre é capaz de adsorver até 5 mols de CO2 , uma quantidade bem superior ao que se conhece até então. Com base nessas informações, pode-se concluir que a porcentagem em massa de cobre no sólido é cerca de
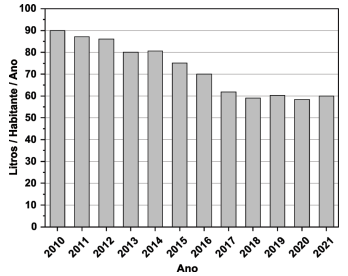
Dados:
i) ingestão total de energia diária para adultos: 8400 kJ (recomendação da OMS).
ii) energia por grama de açúcar: 16,5 kJ.
De acordo com as informações do gráfico e do texto 1, pode-se afirmar que a média de consumo diário de açúcar, por habitante, para cada ano, devido somente à ingestão de refrigerante,
CH4(g) + 3 Cl2(g) → CHCl3(l) + 3 HCl(g)
A quantidade de cloro, em gramas, necessária para produzir 1,5 mol de clorofórmio é