Questões de Concurso
Foram encontradas 191 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Em uma reação de oxirredução com potencial padrão de reação positivo e com diminuição na energia livre de Gibbs, é observado um processo espontâneo.
Considere que uma determinada indústria afirma que utiliza gás natural como combustível para a operação de uma caldeira em sua planta. No entanto, a análise da amostra dos gases da chaminé, logo após a caldeira, revela que há emissão de SO2 , indicando que o combustível utilizado não é gás natural.
Para a determinação do tipo de combustível, foram disponibilizadas as informações presentes nas seguintes tabelas.
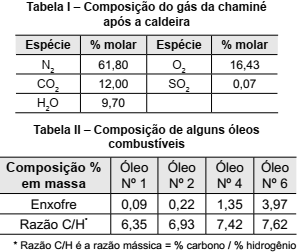
Dados: Massas molares C = 12 g/mol; H = 1 g/mol e S = 32 g/mol.
Considerando que o combustível seja composto apenas
por carbono, hidrogênio e enxofre, o óleo utilizado na
caldeira, de acordo com os dados da tabela II, é o de
número
Indústrias que operam com compostos sulfurados geralmente geram ácido sulfídrico (H2S), um gás altamente irritante para os olhos e vias respiratórias, além de possuir um odor desagradável de ovo podre. O processo Claus é uma alternativa para o tratamento desse poluente. Nele, parte do H2S é queimado em uma fornalha para se produzir SO2 , conforme apresentado na equação 1 a seguir.
H2S + 3/2 O2 → SO2 + H2O (1)
Os gases que saem da fornalha são misturados à outra parte de H2S e são alimentados em um reator catalítico, onde o enxofre elementar é formado, conforme equação 2 a seguir.
2H2S + SO2 → 2H2O + 3S (2)
Com base nesse processo, é correto afirmar que
Considere, em um sistema ideal, que uma chaminé recebeu 2,4 x 1019 moléculas de SO2 que foram misturadas com 10 g do carbonato de cálcio. Nessas condições, quantos miligramas, aproximadamente, de sulfato de cálcio ficariam retidos na chaminé?
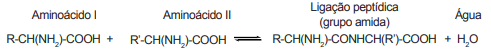 Considere que 2 mols de molécula do aminoácido I são adicionados para reagir com 1 mol de molécula do aminoácido II.
Quando o equilíbrio químico é estabelecido (equilíbrio 1), 20% do aminoácido I é consumido. Em seguida, adicionou-se
certa quantidade de mols de molécula do aminoácido II, e 10% do aminoácido I foi consumido até reestabelecer um novo
equilíbrio (equilíbrio 2).
Nessas condições, qual é a razão aproximada entre o primeiro e segundo equilíbrios?
Considere que 2 mols de molécula do aminoácido I são adicionados para reagir com 1 mol de molécula do aminoácido II.
Quando o equilíbrio químico é estabelecido (equilíbrio 1), 20% do aminoácido I é consumido. Em seguida, adicionou-se
certa quantidade de mols de molécula do aminoácido II, e 10% do aminoácido I foi consumido até reestabelecer um novo
equilíbrio (equilíbrio 2).
Nessas condições, qual é a razão aproximada entre o primeiro e segundo equilíbrios?