Questões de Química - Termoquímica: Energia Calorífica, Calor de reação, Entalpia, Equações e Lei de Hess. para Concurso
Foram encontradas 102 questões
Q1807665
Química
O propano, de fórmula C3H8, pode ser obtido da destilação fracionada do petróleo e é um importante
componente do GLP (Gás Liquefeito de Petróleo), porém sua entalpia de formação não pode ser medida de
maneira direta.
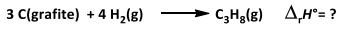
Observe as reações a seguir:
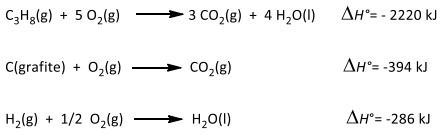
De acordo com as reações acima e os dados fornecidos, o valor da entalpia padrão de formação do gás propano, em quilojoules, é igual a:
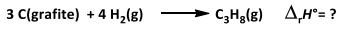
Observe as reações a seguir:

De acordo com as reações acima e os dados fornecidos, o valor da entalpia padrão de formação do gás propano, em quilojoules, é igual a:
Ano: 2021
Banca:
SELECON
Órgão:
EMGEPRON
Prova:
SELECON - 2021 - EMGEPRON - Técnico Química (Fábrica de Munições) |
Q1774675
Química
Um forno aceso em um fogão doméstico por uma hora tem seu consumo variável, dependendo do fabricante e modelo. Mas, em média, o gasto para um fogo médio equivale a 0,225 kg de gás. Um fogão alimentado por gás natural, formado exclusivamente pelo gás metano, terá ao final de uma hora liberado, aproximadamente, uma quantidade de energia, em kJ, igual a:
Reação de combustão do metano:
CH4(g) + 2 O2(g) → CO2(g) + 2 H2 O(g) ΔH = - 890,4 kJ/mol
Reação de combustão do metano:
CH4(g) + 2 O2(g) → CO2(g) + 2 H2 O(g) ΔH = - 890,4 kJ/mol
Q1772855
Química
O gás natural é um combustível cujo principal
componente é o metano. As entalpias-padrão de
formação das substâncias compostas participantes
da reação de combustão do metano são
apresentadas a seguir.
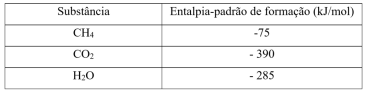
A entalpia-padrão de combustão do metano, em kJ/mol, corresponde a:

A entalpia-padrão de combustão do metano, em kJ/mol, corresponde a:
Ano: 2021
Banca:
SELECON
Órgão:
EMGEPRON
Prova:
SELECON - 2021 - EMGEPRON - Químico (Fabril Farmacêutico) |
Q1772390
Química
Apresenta-se, a seguir, o ciclo de Born-Haber no
cloreto de sódio e suas respectivas energias:
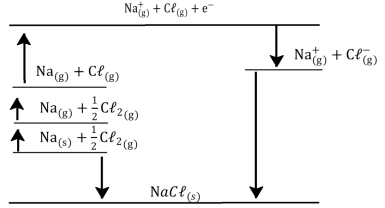
energia de ionização do Na = + 496 kJ.mol – 1 afinidade eletrônica do Cℓ = + 349 kJ.mol – 1 entalpia de atomização Na = + 107 kJ.mol – 1 entalpia de atomização Cℓ = + 122 kJ.mol entalpia padrão de formação do NaCℓ = – 411 kJ.mol – 1

energia de ionização do Na = + 496 kJ.mol – 1 afinidade eletrônica do Cℓ = + 349 kJ.mol – 1 entalpia de atomização Na = + 107 kJ.mol – 1 entalpia de atomização Cℓ = + 122 kJ.mol entalpia padrão de formação do NaCℓ = – 411 kJ.mol – 1
A entalpia de rede do cloreto de sódio é:
Ano: 2021
Banca:
SELECON
Órgão:
EMGEPRON
Prova:
SELECON - 2021 - EMGEPRON - Químico (Fabril Farmacêutico) |
Q1772381
Química
Medir diretamente a entalpia de formação do
benzeno a partir da reação entre carbono e gás
hidrogênio é uma tarefa muito difícil, porém pode-se
fazer uso da Lei de Hess, usando as equações de
oxidação a seguir:
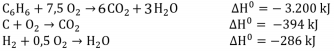
Conclui-se que o ΔH de formação do benzeno é:
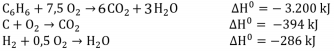
Conclui-se que o ΔH de formação do benzeno é: