Questões Militares Comentadas para espcex
Foram encontradas 684 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Considere a equação da reação hipotética: X + Y + Z → W + T + Q
São conhecidos os seguintes resultados do estudo cinético desta reação, obtidos nas mesmas condições experimentais:
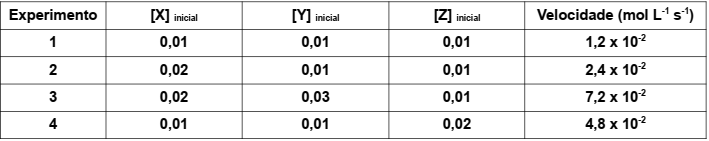
Considere [ ] = concentração mol L-1
.
A partir das observações experimentais, conclui-se que a equação da velocidade para a reação é
“Em 1836, o químico inglês John Frederic Daniell construiu uma pilha usando metais e soluções aquosas de sais. A pilha funcionava a partir de dois eletrodos interligados. O eletrodo é, geralmente, um sistema constituído por um metal imerso em uma solução aquosa de um sal formado pelos cátions desse metal.”
Adaptado de: FONSECA, Martha Reis Marques. Química. São Paulo: Editora FTD, 2007. v. 2: Físico-Química. p. 276.
Considere a representação da notação química da pilha de Daniell (usando eletrodos de cobre e zinco), de acordo com a União Internacional de Química Pura e Aplicada (IUPAC):
Zn (s) | Zn2+ (aq) (1 mol L-1) || Cu2+ (aq) (1 mol L-1) | Cu (s).
Dados os potenciais padrão de redução E0 Zn = - 0,76 V e E0 Cu = + 0,34 V, e considerando o funcionamento da referida pilha em condições padrão, afirma-se que
I – no eletrodo de cobre dessa pilha ocorre a corrosão da placa metálica de cobre.
II – a diferença de potencial (d.d.p.) teórica dessa pilha é de + 1,10 V.
III – nessa pilha os elétrons fluem no circuito externo, do eletrodo de zinco para o eletrodo de cobre.
IV – o símbolo de duas barras paralelas ( || ) representa a ponte salina (ou uma membrana porosa), cuja finalidade é manter as duas semicelas eletricamente neutras, por meio da migração de íons (corrente iônica).
V – a equação da reação global dessa pilha é Zn2+ (aq) + Cu (s) → Zn (s) + Cu2+ (aq).
Das afirmativas feitas, estão corretas apenas
Leia os textos a seguir e resolva a questão:
“Nas equações químicas, tanto as substâncias transformadas (reagentes) como as produzidas são representadas por fórmulas. As fórmulas das substâncias indicam elementos que as constituem e, também, a quantidade de átomos de cada elemento. O número que indica essa quantidade de átomos é chamado índice, que é anotado à direita do símbolo de cada elemento. (...)
A quantidade de cada substância que participa da reação é indicada por números escritos antes de suas fórmulas, denominados coeficientes estequiométricos, que devem ser os menores números inteiros possíveis.”
Fonte: USBERCO, João e SALVADOR, Edgard. Química. 14ª ed. Reform - São Paulo: Editora Saraiva, 2009. v. 1: Química Geral. p. 385.
“Em uma reação de oxidorredução, o mais comum é que uma espécie se oxide e outra se reduza. Porém, podem ocorrer casos com duas ou mais oxidações e apenas uma redução ou viceversa. De qualquer maneira, para o balanceamento desse tipo de reação, o princípio é sempre o mesmo: n° de elétrons perdidos = n° de elétrons recebidos.”
Fonte: USBERCO, João e SALVADOR, Edgard. Química. 14ª ed. Reform - São Paulo: Editora Saraiva, 2009. v. 2: Físico-Química. p. 250.
Considere a seguinte equação de reação química de oxidorredução não balanceada:
As2S3 + NH4OH + H2O2 → (NH4)3AsO4 + (NH4)2SO4 + H2O
Acerca desta reação química de oxidorredução e de suas espécies, são feitas as seguintes afirmativas:
I – O peróxido de hidrogênio é o agente redutor.
II – Após o devido balanceamento, o coeficiente estequiométrico da água é 20.
III – O arsênio da substância As2S3 é reduzido, enquanto o enxofre é oxidado.
IV – O (NH4)2SO4 é um sal cujo nome é sulfito de amônio.
V – Após o devido balanceamento, a soma de todos os coeficientes estequiométricos da equação é igual a 52.
Das afirmativas feitas, estão corretas apenas
No estado sólido, o dióxido de carbono é conhecido como gelo seco. Em condições ambientes (25 ºC e 1 atm), ele passa do estado sólido para o estado de vapor. Acerca do dióxido de carbono, são feitas as seguintes afirmativas:
I – O dióxido de carbono é classificado como uma substância simples.
II – O dióxido de carbono é uma substância que sublima em condições ambientes.
III – A molécula do dióxido de carbono apresenta geometria angular.
IV – O dióxido de carbono é um óxido ácido que, em condições adequadas, pode reagir com água e produzir o ácido carbônico.
V – Quando se borbulha dióxido de carbono em uma solução aquosa de hidróxido de cálcio, sob condições adequadas, produz-se carbonato de cálcio e água.
VI – A hibridização do átomo de carbono na molécula do dióxido de carbono é sp2 .
Das afirmativas feitas, estão corretas apenas
Leia o texto a seguir e resolva a questão:
“ Batalhão realiza marcha a pé de 8 k m, como atividade
do Programa de Instrução de 2021
Aquidauana (MS) – No dia 11 de março, o 9º Batalhão de Engenharia de Combate (9º BE Cmb), Batalhão Carlos Camisão, seguindo o cronograma de Instrução de 2021, realizou a marcha a pé de 8 km. A atividade teve por finalidade desenvolver a rigidez, disciplina no deslocamento a pé, capacitação profissional e manutenção da operacionalidade da tropa.”
Fonte: https://www.eb.mil.br/web/noticias/noticiario-do-exercito. Acessado em 16 MAR 21.
Atividades físicas intensas promovem a perda de água e de eletrólitos. Para repor essas perdas, soldados podem consumir um repositor hidroeletrolítico durante a atividade de campanha. Esses repositores são constituídos de uma solução aquosa contendo várias substâncias químicas, principalmente sais.
Considere um repositor que possua as seguintes especificações: cada porção de 200 mL contém 90 mg de íons sódio, 24 mg de íons potássio e 84 mg de íons cloreto.
Baseado nestas informações, são feitas as seguintes afirmativas:
I) A concentração de íons sódio na solução é de 0,45 g L-1 .
II) Cada litro do repositor possui aproximadamente 3,1 x 10-3 mol de íons potássio.
III) A temperatura de congelamento de uma porção de repositor é maior do que a temperatura de congelamento da água pura nas mesmas condições.
IV) Para se obter 0,2 mol de íons cloreto, seriam necessários aproximadamente 100 litros de repositor.
Das afirmativas feitas, estão corretas apenas