Questões Militares
Foram encontradas 34 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
II. Os elementos constituintes de ligas metálicas, como o bronze, podem ser separados por fusão.
III. A filtração a pressão reduzida, usando um funil de Büchner, é um processo utilizado para reduzir o tempo de separação de um sólido suspenso em um líquido.
IV. A temperatura aumenta continuamente no aquecimento de uma mistura simples, mesmo durante a fusão e a ebulição. Assinale a opção que contém a(s) afirmação(ões) CORRETA(S).
II. O modelo de Dalton contém o arcabouço teórico minimamente necessário para representar uma equação do tipo: 12 Fe(s)+ C(s) → Fe12C(s).
III. O modelo de Rutherford contém o arcabouço teórico minimamente necessário para representar uma equação do tipo: 24He2+ + Au → 24He2+ + Au.
IV. O modelo de Thomson contém o arcabouço teórico minimamente necessário para representar uma equação do tipo: 2H+ + 2e- ⇋ H2.
Assinale a opção que contém a(s) afirmação(ões) CORRETA(S) sobre a relação entre os
modelos atômicos e as equações químicas mostradas.

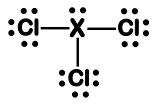
I. A molécula adota uma estrutura trigonal plana, com ângulo de ligação Cl-X-Cl maior ou igual a 120°.
II. A molécula adota uma estrutura tetraédrica, com ângulo de ligação Cl-X-Cl maior que 109,5°.
III. O átomo “X” pode ser o nitrogênio, preservando a geometria molecular. IV. O átomo “X” pode ser o boro, preservando a geometria molecular.
Assinale a opção que contém a(s) afirmação(ões) CORRETA(S):
De acordo com o diagrama, a relação entre a cor e o que ela representa na classificação de riscos de produtos químicos está corretamente indicada em