Questões de Concurso Militar EsPCEx 2013 para Cadete do Exército - 1° Dia
Foram encontradas 3 questões
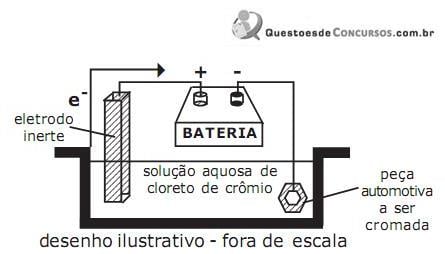
nessa peça foi de
Dados:
massas atômicas Cr = 52 u e Cl = 35,5 u.
1 Faraday = 96500 C/mol de e-
Quando a temperatura cai, o reluzente estanho metálico exposto ao oxigênio do ar começa a se tornar friável e a se esboroar (desfazer) num pó acinzentado e não metálico - continua sendo estanho, mas com forma estrutural diferente”. (Adaptado de Os Botões de Napoleão - Penny Le Couteur e Jay Burreson - Pag 8).
I – o texto faz alusão estritamente a ocorrência de fenômenos físicos.
II – o texto faz alusão a ocorrência de uma reação de oxidação do estanho do botão.
III – o texto faz alusão a ocorrência de uma reação de síntese.
IV – o texto faz alusão a ocorrência de uma reação sem transferência de elétrons entre espécies estanho metálico e o oxigênio do ar.
Das afirmativas apresentadas estão corretas apenas:
Baseando-se nos potenciais padrão de redução das semi-reações a seguir, são feitas as seguintes afirmativas:
Sn 2+ (aq) + 2 e- → Sn (s) E0 red = - 0,14 V
Li+ (aq) + 1 e- → Li (s) E0 red = - 3,04 V
I-O estanho cede elétrons para o lítio.
II-O eletrodo de estanho funciona como cátodo da pilha.
III-A reação global é representada pela equação: 2 Li0 (s)+ Sn2+ (aq) → Sn0 (s) + 2 Li+ (aq)
IV-No eletrodo de estanho ocorre oxidação.
V-A diferença de potencial teórica da pilha é de 2,90 V, (∆E = + 2,90 V).
Das afirmativas apresentadas estão corretas apenas: