Questões Militares de Química - Termoquímica: Energia Calorífica, Calor de reação, Entalpia, Equações e Lei de Hess.
Foram encontradas 31 questões
Devido ao intenso calor liberado, reações de termita são bastante utilizadas em aplicações militares como granadas incendiárias ou em atividades civis como solda de trilhos de trem. A reação de termita mais comum é a aluminotérmica, que utiliza como reagentes o alumínio metálico e o óxido de ferro III.
A reação de termita aluminotérmica pode ser representada pela equação química não balanceada:
Al (s) + Fe2O3 (s) → Fe (s) + Al2O3 (s) + Calor
Dados: valores arredondados de entalpias padrão de formação das espécies ∆Ho fAl2O3 = - 1676 kJ/ mol; ∆Ho f Fe2O3 = - 826 kJ/mol
Acerca desse processo, são feitas as seguintes afirmativas:
I – Após correto balanceamento, o coeficiente do reagente alumínio na equação química é 2.
II – Essa é uma reação de oxidorredução e o agente oxidante é o óxido de ferro III.
III – Na condição padrão, o ∆H da reação é - 503 kJ para cada mol de óxido de alumínio produzido.
IV – Na condição padrão, para a obtenção de 56 g de ferro metálico, o calor liberado na reação é de 355 kJ.
Assinale a alternativa que apresenta todas as afirmativas corretas, dentre as listadas acima.

I – O agente oxidante dessa reação é o O2.
II – O coeficiente estequiométrico da água, após o balanceamento da equação, é 2.
III – Considerando a densidade do etanol 0,8 g/mL (25 ºC; 1 atm), a combustão completa de 1150 mL desse composto libera aproximadamente 27360 kJ.
IV – A quantidade de calor liberada na combustão de 1 mol de etanol é de 278 kJ·mol-1.
Das afirmativas feitas estão corretas apenas
O trioxano, cuja fórmula estrutural plana simplificada encontra-se representada a seguir, é utilizado em alguns países como combustível sólido para o aquecimento de alimentos armazenados em embalagens especiais e que fazem parte das rações operacionais militares.
Considere a reação de combustão completa de um tablete de 90 g do trioxano com a formação de CO2 e H2O. Baseado nas energias de ligação fornecidas na tabela abaixo, o valor da entalpia de combustão estimada para esta reação é
Dados:
Massas Atômicas: O=16 u ; H = 1 u ; C=12 u.

Algumas viaturas militares administrativas possuem motores à combustão que utilizam como combustível a gasolina. A queima (combustão) de combustíveis como a gasolina, nos motores à combustão, fornece a energia essencial para o funcionamento dessas viaturas militares. Considerando uma gasolina na condição padrão (25 °C e 1 atm), composta apenas por n-octano (C8H18) e que a sua combustão seja completa (formação exclusiva de CO2 e H2O gasosos como produtos), são feitas as seguintes afirmativas:
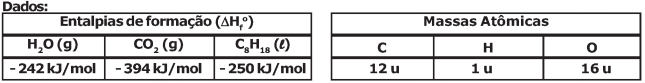
I - a combustão da gasolina (C8H18) é uma reação exotérmica;
II - na combustão completa de 1 mol de gasolina, são liberados 16 mols de gás carbônico (CO2);
III - a entalpia de combustão (calor de combustão) dessa gasolina é - 5080 kJ/mol (ΔHc=-5080 kJ/mol);
IV - o calor liberado na combustão de 57 g de gasolina é de 1270 kJ.
Das afirmativas apresentadas estão corretas apenas a