Questões Militares de Química - Soluções e Substâncias Inorgânicas
Foram encontradas 291 questões
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

(1) O volume da solução de permanganato de potássio gasto na titulação foi de 100 mL. (2) O menor coeficiente estequiométrico inteiro para Fe2+ na reação redox balanceada é 7. (3) No ponto final, o volume total da solução será de 120 mL. (4) Um precipitado sólido de cor esverdeada será observado como produto dessa reação. (5) O número total de elétrons envolvidos na reação redox é 22 milimols. (6) A razão entre os volumes do titulante e do titulado no ponto final é 2,1.
A soma dos números associados às afirmações CORRETAS é igual a
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

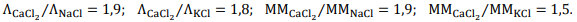
Com base nessas informações, assinale a opção CORRETA entre as condutividades das soluções.
I. NH4+ + NH2– → 2NH3. II. CH3NH2 + H2O → CH3NH3+ + OH– III. SO3 2– + S → S2O3 2–
As espécies que atuam como ácido nas reações representadas em I, II e III são, respectivamente,
Considere a curva de solubilidade da sacarose.
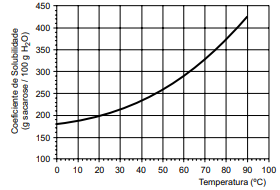
A temperatura em que se iniciou a cristalização e a massa máxima de açúcar cristalizada na solução em repouso a 20 ºC são, correta e respectivamente,