Questões Militares de Engenharia Química e Química Industrial - Termodinâmica e Equilíbrio de Fases
Foram encontradas 98 questões
No estudo da precipitação de íons metálicos, existem vários diagramas que podem ser utilizados, como o de precipitação, o de especiação e o diagrama Eh-pH. Nesse último, para uma faixa de potenciais (Eh) e de pH, podem ser observados todas as espécies presentes, para uma temperatura e concentração do elemento de interesse.
A seguir pode-se observar o diagrama Eh-pH para o cádmio em solução aquosa.
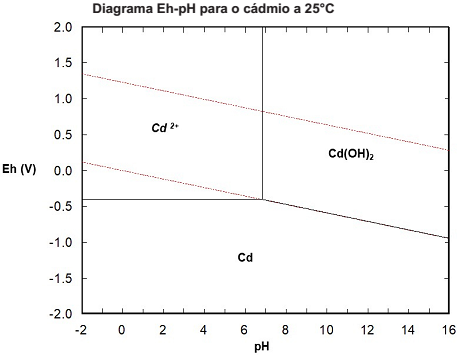
Fonte: Arquivo da Banca Elaboradora.
A partir desse diagrama, é correto afirmar que
Diagramas ternários são diagramas utilizados para sistemas compostos por três substâncias. Os diagramas ternários podem ter o formato de um triângulo equilátero ou um triângulo retângulo. A figura abaixo é um diagrama triângulo retângulo para um sistema composto por ácido acético, água e éter isopropílico, a 20°C.
Nesse diagrama, as linhas sólidas representam a separação entre as regiões em que há somente uma fase ou duas fases em equilíbrio, e as linhas tracejadas representam as linhas de amarração.
Diagrama triângulo retângulo para o sistema ácido acético, água, éter isopropílico a 20°C
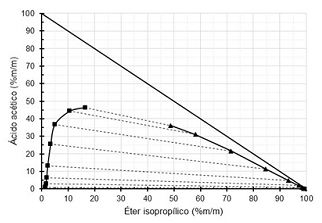
Fonte: Arquivo da Banca Elaboradora.
Um aluno observando esse diagrama fez algumas anotações.
I. Ácido acético é completamente solúvel em água.
II. Ácido acético e éter isopropílico são parcialmente solúveis entre si.
III. Água e éter isopropílico são parcialmente solúveis entre si.
IV. É impossível remover ácido acético de uma solução aquosa utilizando éter isopropílico.
V. Não é possível saber, pelo diagrama, a concentração de água em um determinado ponto.
É correto apenas o que o aluno afirmou em:
Um tubo cilíndrico fechado nas extremidades é dividido em dois compartimentos (A e B) por um pistão móvel. No compartimento A foi adicionado 1g de um gás ideal, que possui massa molar M, a 300K. No compartimento B foi adicionado 1g de um outro gás ideal, que possui massa molar 2M, a 900K.
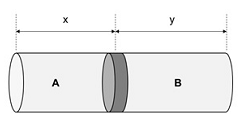
Fonte: Arquivo da Banca Elaboradora.
Quando o sistema entrar em equilíbrio mecânico, a razão entre os comprimentos y e x, será igual a
A seguir são apresentadas as entalpias de formação de alguns compostos. Analise-as
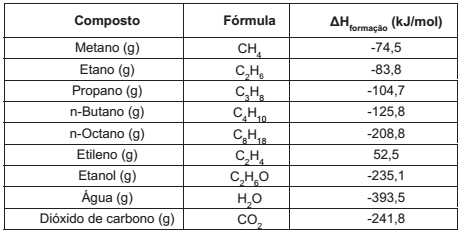
SMITH, J. M.; VAN NESS, H. C.; ABBOTT, M. M. Introdução à termodinâmica da Engenharia Química. 7 ed. Rio de Janeiro: LTC, 2007. p. 514-515.
A partir da análise desses dados, é correto afirmar que
As equações a seguir são as relações termodinâmicas fundamentais para 1 mol de um fluido homogêneo com composição constante.
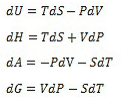
As propriedades termodinâmicas expressas nessas equações são: energia interna (U), entalpia (H), energia de Helmholtz (A), energia de Gibbs (G), temperatura (T), pressão (P), volume (V) e entropia (S).
A partir dessas relações fundamentais, é possível encontrar outras correlações que permitem realizar
experimentos simples para estudos bastante complexos. Por exemplo, caso queira verificar como a energia
de Gibbs varia com a entropia, mantendo-se a temperatura constante, pode-se utilizar os dados de um
experimento em que observa-se a variação da(o)