Questões ENEM de Química - Termoquímica: Energia Calorífica, Calor de reação, Entalpia, Equações e Lei de Hess.
Foram encontradas 17 questões
A obtenção de energia por meio da fissão nuclear do 235U é muito superior quando comparada à combustão da gasolina. O calor liberado na fissão do 235U é 8 x 1010 J/g e na combustão da gasolina é 5 x 104 J/g.
A massa de gasolina necessária para obter a mesma energia na fissão de 1 kg de 235U é da ordem de
Para comparar a eficiência de diferentes combustíveis, costuma-se determinar a quantidade de calor liberada na combustão por mol ou grama de combustível. O quadro mostra o valor de energia liberada na combustão completa de alguns combustíveis.
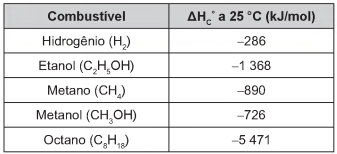
As massas molares dos elementos H, C e O são iguais a 1 g/mol, 12 g/mol e 16 g/mol, respectivamente.
ATKINS, P Princípios de química. Porto Alegre: Bookman, 2007 (adaptado).
Qual combustível apresenta maior liberação de energia
por grama?
Atualmente, soldados em campo, seja em treinamento ou em combate, podem aquecer suas refeições, prontas e embaladas em bolsas plásticas, utilizando aquecedores químicos, sem precisar fazer fogo. Dentro dessas bolsas existe magnésio metálico em pó e, quando o soldado quer aquecer a comida, ele coloca água dentro da bolsa, promovendo a reação descrita pela equação química:
Mg (s) + 2 H2O (I) → Mg(OH)2 (s) + H2 (g) + 350 kJ
O aquecimento dentro da bolsa ocorre por causa da
O ferro é encontrado na natureza na forma de seus minérios, tais como a hematita (α-Fe2 O3), a magnetita (Fe3O4) e a wustita (FeO). Na siderurgia, o ferro-gusa é obtido pela fusão de minérios de ferro em altos fornos em condições adequadas. Uma das etapas nesse processo é a formação de monóxido de carbono. O CO (gasoso) é utilizado para reduzir o FeO (sólido), conforme a equação química:
FeO (s) + CO (g) → Fe (s) + CO2(g)
Considere as seguintes equações termoquímicas:
Fe2O3 (s) + 3 CO (g) → 2 Fe (s) + 3 CO2 (g) ΔrH = -25 kJ/mol de Fe2O3
= -25 kJ/mol de Fe2O3
3 FeO (s) + CO2 (g) → Fe3O4 (s) + CO (g) ΔrH = -36 kJ/mol de CO2
= -36 kJ/mol de CO2
2 Fe3O4 (s) + CO2 (g) → 3 Fe2O3 (s) + CO (g) ΔrH = +47 kJ/mol de CO2
= +47 kJ/mol de CO2
O valor mais próximo de ΔrH , em kJ/mol de FeO, para a reação indicada do FeO (sólido) com o CO (gasoso) é
, em kJ/mol de FeO, para a reação indicada do FeO (sólido) com o CO (gasoso) é
O benzeno, um importante solvente para a indústria química, é obtido industrialmente pela destilação do petróleo. Contudo, também pode ser sintetizado pela trimerização do acetileno catalisada por ferro metálico sob altas temperaturas, conforme a equação química:
3 C2H2 (g) → C6H6 (l)
A energia envolvida nesse processo pode ser calculada indiretamente pela variação de entalpia das reações de combustão das substâncias participantes, nas mesmas condições experimentais:
I. C2H2 (g) + 5/2 O2 (g) → 2 CO2 (g) + H2O (l) ΔHc° = -310 kcal/mol
II. C6H6 (l) + 15/2 O2 (g) → 6 CO2 (g) + 3 H2O (l) ΔHc° = -780 kcal/mol
A variação de entalpia do processo de trimerização, em kcal, para a formação de um mol de benzeno é mais próxima de