Questões ENEM de Química - Representação das transformações químicas
Foram encontradas 59 questões
Usando um densímetro cuja menor divisão da escala, isto é, a diferença entre duas marcações consecutivas, é de 5,0 x 10-2 g cm-3, um estudante realizou um teste de densidade: colocou este instrumento na água pura e observou que ele atingiu o repouso na posição mostrada.
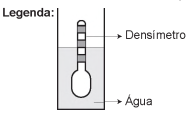
Em dois outros recipientes A e B contendo 2 litros de água pura, em cada um, ele adicionou 100 g e 200 g de NaCl, respectivamente.
Quando o cloreto de sódio é adicionado à água pura ocorre sua dissociação formando os íons Na+ e Cl-. Considere que esses íons ocupam os espaços intermoleculares na solução.
Nestes recipientes, a posição de equilíbrio do densímetro
está representada em:
O carro flex é uma realidade no Brasil. Estes veículos estão equipados com motor que tem a capacidade de funcionar com mais de um tipo de combustível. No entanto, as pessoas que têm esse tipo de veículo, na hora do abastecimento, têm sempre a dúvida: álcool ou gasolina? Para avaliar o consumo desses combustíveis, realizou-se um percurso com um veículo flex, consumindo 40 litros de gasolina e no percurso de volta utilizou-se etanol. Foi considerado o mesmo consumo de energia tanto no percurso de ida quanto no de volta.
O quadro resume alguns dados aproximados sobre esses combustíveis.
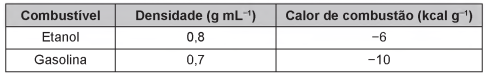
O volume de etanol combustível, em litro, consumido no percurso de volta é mais próximo de
Fator de emissão de CO2 = Massa de CO2 emitida/ Quantidade de material
O termo “quantidade de material” pode ser, por exemplo, a massa de material produzido em uma indústria ou a quantidade de gasolina consumida por um carro em um determinado período.
No caso da produção do cimento, o primeiro passo é a obtenção do óxido de cálcio, a partir do aquecimento do calcário a altas temperaturas, de acordo com a reação:
CaCO3(s) → CaO(s) + CO2(g)
Uma vez processada essa reação, outros compostos inorgânicos são adicionados ao óxido de cálcio, tendo o cimento formado 62% de CaO em sua composição.
Dados: Massas molares em g/mol — CO2 = 44; CaCO3 = 100; CaO = 56.
TREPTOW, R. S. Journal of Chemical Education. v. 87 n° 2, fev. 2010 (adaptado).
Considerando as informações apresentadas no texto, qual é, aproximadamente, o fator de emissão de CO2 quando 1 tonelada de cimento for produzida, levando-se em consideração apenas a etapa de obtenção do óxido de cálcio?
Ácido muriático (ou ácido clorídrico comercial) é bastante utilizado na limpeza pesada de pisos para remoção de resíduos de cimento, por exemplo. Sua aplicação em resíduos contendo quantidades apreciáveis de CaCO3 resulta na liberação de um gás. Considerando a ampla utilização desse ácido por profissionais da área de limpeza, torna-se importante conhecer os produtos formados durante seu uso.
A fórmula do gás citado no texto e um teste que pode ser realizado para confirmar sua presença são, respectivamente:
Pesquisadores conseguiram produzir grafita magnética por um processo inédito em forno com atmosfera controlada e em temperaturas elevadas. No forno são colocados grafita comercial em pó e óxido metálico, tal como CuO. Nessas condições, o óxido é reduzido e ocorre a oxidação da grafita, com a introdução de pequenos defeitos, dando origem à propriedade magnética do material.
VASCONCELOS, Y. Um ímã diferente. Disponível em: http://revistapesquisa.fapesp.br. Acesso em: 24 fev. 2012 (adaptado).
Considerando o processo descrito com um rendimento de 100%, 8 g de CuO produzirão uma massa de CO2 igual a
Dados: Massa molar em g/mol: C = 12; O = 16; Cu = 64