Questões ENEM de Química - Fórmulas, Balanceamento e Leis ponderais das reações químicas
Foram encontradas 24 questões
Os combustíveis de origem fóssil, como o petróleo e o gás natural, geram um sério problema ambiental, devido à liberação de dióxido de carbono durante o processo de combustão. O quadro apresenta as massas molares e as reações de combustão não balanceadas de diferentes combustíveis.
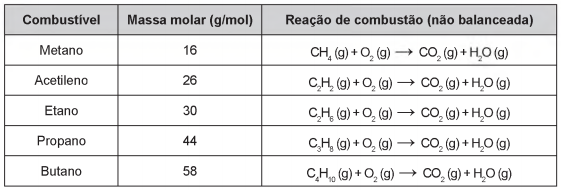
Considerando a combustão completa de 58 g de cada um dos combustíveis listados no quadro, a substância que emite
mais CO2 é o
O ácido acetilsalicílico, AAS (massa molar igual a 180 g/mol), é sintetizado a partir da reação do ácido salicílico (massa molar igual a 138 g/mol) com anidrido acético, usando-se ácido sulfúrico como catalisador, conforme a equação química:
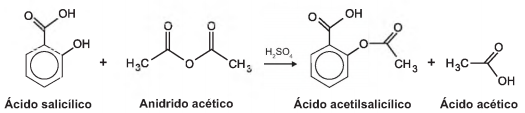
Após a síntese, o AAS é purificado e o rendimento flnal é de aproximadamente 50%. Devido às suas propriedades farmacológicas (antitérmico, analgésico, anti-inflamatório e antitrombótico), o AAS é utilizado como medicamento na forma de comprimidos, nos quais se emprega tipicamente uma massa de 500 mg dessa substância.
Uma indústria farmacêutica pretende fabricar um lote de 900 mil comprimidos, de acordo com as especificações do
texto. Qual é a massa de ácido salicílico, em kg, que deve ser empregada para esse fim?
Para cada litro de etanol produzido em uma indústria de cana-de-açúcar são gerados cerca de 18 L de vinhaça que é utilizada na irrigação das plantações de cana-de-açúcar, já que contém teores médios de nutrientes N, P e K iguais a 357 mg/L, 60 mg/L e 2 034 mg/L, respectivamente.
SILVA, M. A. S.; GRIEBELER, N. P; BORGES, L. C. Uso de vinhaça e impactos nas propriedades do solo e lençol freático. Revista Brasileira de Engenharia Agrícola e Ambiental, n. 1, 2007 (adaptado).
Na produção de 27 000 L de etanol, a quantidade total de fósforo, em kg, disponível na vinhaça será mais próxima de
CaCO3(s) + SO2 (g)
 CaS03(s) + CO2 (g) (1)
CaS03(s) + CO2 (g) (1)Por sua vez, o sulfito de cálcio formado pode ser oxidado, com o auxílio do ar atmosférico, para a obtenção do sulfato de cálcio, como mostrado na equação (2 ). Essa etapa é de grande interesse porque o produto da reação, popularmente conhecido como gesso, é utilizado para fins agrícolas.
2 CaSO3(s) + O2(g)
 2 CaS04(s) (2)
2 CaS04(s) (2)As massas molares dos elementos carbono, oxigênio, enxofre e cálcio são iguais a 12 g/mol, 16 g/mol, 32 g/mol e 40 g/mol, respectivamente.
BAIRD, C. Química ambiental. Porto Alegre: Bookman, 2002 (adaptado).
Considerando um rendimento de 90% no processo, a massa de gesso obtida, em gramas, por mol de gás retido é mais próxima de
LEE. J. D Química Inorgânica não tão concisa. São Paulo: Edgard Blucher. 1999 (adaptado).
Considerando que um forno foi alimentado com 2,5 toneladas de ferro-gusa, a massa de gás carbônico formada, em quilogramas, na produção de aço doce, é mais próxima de