Questões de Vestibular UEMG 2019 para Vestibular - EAD - Prova 12
Foram encontradas 6 questões
Porque:
As altas temperaturas no interior das estrelas extinguem alguns átomos de hidrogênio, resultando na redução da massa observada durante o processo.
Sobre essa duas afirmativas, é correto afirmar que
Quem propôs este modelo?
Considerando as propriedades descritas, o dióxido de silício e o dióxido de enxofre são, respectivamente, substâncias do tipo
Considere a dissolução do cloreto de cálcio, utilizado para compressas quentes.
CaCl 2(s) + H2O(l) → Ca2+ (aq) + 2 Cl – (aq). ∆H = - 82,8 kJ / mol.
A dissolução de 1,0 mol de CaCl 2(s) libera 82,8 kJ de energia. Esse calor eleva a temperatura de 1,0 L de água de 20°C para 40°C. A dissolução de 0,5 mol de CaCl 2(s) em 1,0 L de água eleva a temperatura de 20°C para
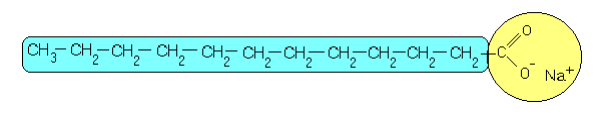
Os sabões são capazes de remover gorduras, ao contrário da água, porque a