Questões de Vestibular CESMAC 2015 para Prova Medicina-2016.1- 2° DIA- PROVA TIPO 1
Foram encontradas 20 questões
1) O NOX do cobalto é +3, pois tem-se o íon Co3+ .
2) Apresenta ligações iônicas e covalentes coordenadas.
3) O íon nitrato apresenta carga 1−.
Está(ão) correta(s):

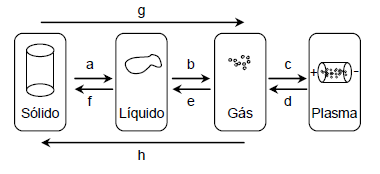 1) As transformações a, b, c e g ocorrem com o
aumento da entropia.
1) As transformações a, b, c e g ocorrem com o
aumento da entropia.
2) As transformações g e h correspondem à sublimação e à condensação, respectivamente.
3) As transformações e e f correspondem à condensação e à solidificação, respectivamente.
Está(ão) correta(s):
Dados: Massas molares em g . mol−1 : H = 1; C = 12; N = 14; O = 16.
Fórmula molecular da creatinina: C4H7N3O
x Au(s) + y NO3− (aq) + w H+ (aq) + z Cl− (aq) → a AuCl4− (aq) + b H2O(l) + d NO(g)
Após balancear a equação acima com os menores números possíveis, correspondentes, a soma dos coeficientes estequiométricos será:
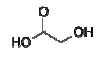 e é produzido pela reação do ácido cloroacético com o
hidróxido de sódio seguida por uma re-acidificação. A
reação pode ser equacionada da seguinte maneira:
e é produzido pela reação do ácido cloroacético com o
hidróxido de sódio seguida por uma re-acidificação. A
reação pode ser equacionada da seguinte maneira:
ClCH2CO2H + NaOH → HOCH2CO2H + NaCl
Desta forma, alguns milhões de quilogramas de ácido glicólico são produzidos anualmente.
Calcule a quantidade de ácido glicólico produzida a partir de 200 g de ácido cloroacético e 70,0 g de hidróxido de sódio. Dados: Massas molares em g . mol−1 : H = 1; C = 12; O = 16; Na = 23; Cl = 35,5.