Questões de Vestibular de Química - Sistemas Homogêneos: Constantes: Kc e Kp. Deslocamento do Equilíbrio: Fatores.
Foram encontradas 229 questões
I. Ocorrerá aumento do pH dessa solução. II. Ocorrerá diminuição do pH dessa solução. III. Não ocorrerá alteração do pH. IV. Ocorrerá precipitação de Ca(OH)2.
Marque a alternativa que indica a(s) afirmação(ões) correta(s):
2 CO (g) + O2 (g) ⇋ 2 C02 (g)
Em um determinado recipiente, contendo inicialmente monóxido de carbono e oxigênio, estabeleceuse um equilíbrio em que se pode determinar a pressão total da mistura, 6,1 atm, e as pressões parciais de monóxido de carbono e de dióxido de carbono, as quais foram, respectivamente, 0,5 atm e 4,0 atm.
O valor da constante de equilíbrio será igual a
H2(g) ⇋ 2 H (g)
Sobre essa reação, são feitas as seguintes afirmações.
I - A quantidade de hidrogênio atômico aumenta com o aumento da temperatura, porque a reação é endotérmica. II - Em condições de baixa temperatura, não há energia suficiente para romper a ligação. III- A variação de entalpia envolvida na reação é o dobro da entalpia de formação do hidrogênio atômico nas condições da reação.
Quais estão corretas?
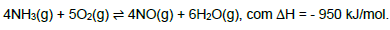
Quando a reação atinge o equilíbrio, uma maneira de aumentar a produção de NO(g) é aumentando a(o):
Para estudar equilíbrio químico de íons Co2+ em solução, uma turma de estudantes realizou uma série de experimentos explorando a seguinte reação:
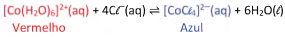
Nesse equilíbrio, o composto de cobalto com água, [Co(H2O)6]2+(aq), apresenta coloração vermelha, enquanto o composto com cloretos, [CoCl4]2-(aq), possui coloração azul.
Para verificar o efeito de ânions de diferentes sais nessa mudança de cor, 7 ensaios diferentes foram realizados. Aos tubos contendo apenas alguns mL de uma solução de nitrato de cobalto II, de coloração vermelha, foram adicionadas pequenas quantidades de diferentes sais em cada tubo, como apresentado na tabela, com exceção do ensaio 1, no qual nenhum sal foi adicionado.
Após agitação, os tubos foram deixados em repouso por um tempo, e a cor final foi observada.
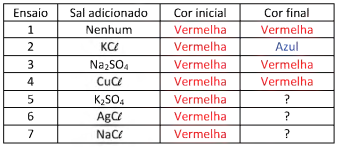
A alternativa que representa a cor final observada nos ensaios 5, 6 e 7, respectivamente, é:
Note e adote:
Solubilidade dos sais em g/100 mL de água a 20 °C
AgCℓ 1,9 x 10-4 NaCℓ 35,9
CuCℓ 9,9 x 10-3 Na2SO4 13,9
KCℓ 34,2 K2SO4 11,1
