Questões de Concurso
Para cesgranrio
Foram encontradas 54.016 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Qual é o valor, em m2 , da área necessária de transferência de calor?
Nesse caso, o tipo de manutenção aplicada para esse mancal foi a
Qual é, aproximadamente, a disponibilidade desse equipamento?
Qual é o valor da estricção, em %, nesse ensaio de tração?
Quando se compararam os produtos obtidos em ambas as reações, constatou-se a formação de
Na Tabela a seguir, são apresentados três alcenos isômeros.
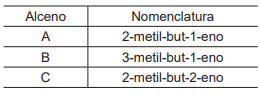
A representação em ordem crescente de energia liberada na combustão de 1 mol do alceno é a seguinte
I - Reação entre eteno e água em meio ácido.
II - Reação do produto formado em I com ácido clorídrico concentrado.
III - Reação do produto orgânico formado em II com benzeno catalisado por AlCl3 .
O principal produto orgânico formado na etapa III é o
Essa etapa tem como objetivo a(o)
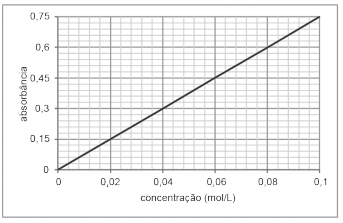
Uma amostra correspondendo a uma solução aquosa contendo Cu+2 passou pelo seguinte procedimento: uma alíquota de 10 mL dessa amostra foi completamente diluída em água até atingir um volume final de solução de 50 mL; uma alíquota dessa solução foi analisada no espectrômetro obtendo-se uma absorbância igual a 0,45.
A concentração de Cu+2 na amostra inicial, em mol L-1 , é
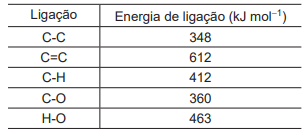
A variação de entalpia, em kJ mol-1 , da reação correspondente a esse processo industrial é
Nessa temperatura, o valor da constante do produto de solubilidade desse sal é, aproximadamente,
Nessa temperatura, o pKa desse ácido é igual a
Dado log 7 = 0,85
Dentre os ácidos formados pelo cloro, aquele que apresenta o menor grau de ionização corresponde ao
BrO3 - (aq) + 6 H+ (aq) + 6 e- → Br- (aq) + 3 H2 O (l) Eo red = +1,44 V
I2 (s) + 2 e- → 2 I- (aq) Eº red = +0,54 V
Em relação à pilha formada, observa-se que
I - C (s) + H2 O (v) → CO (g) + H2 (g) ∆H° = -28.000 cal mol-1 II - CO (g) + H2 O (v) → CO2 (g) + H2 (g) ∆H° = +9.400 cal mol-1 III - C (s) + 2 H2 O (v) → CO2 (g) + 2 H2 (g)
Considerando-se essas informações, a variação de entalpia, em cal mol-1 , da equação termoquímica III é
A amostra reagiu com uma solução de íons oxalato em excesso, acarretando a precipitação de MgC2 O4 , conforme apresentado na reação I. Considere que o magnésio foi o único componente da amostra a precipitar.
Em seguida, o precipitado foi filtrado, lavado e calcinado (reação II), gerando uma amostra sólida de 3,05 g.
Reação I: Mg2+ (aq) + C2 O4 2- (aq) → MgC2 O4 (s)
Reação II: MgC2 O4 (s) → MgO (s) + CO (g) + CO2 (g)
A concentração, em g L-1, de magnésio na amostra é
Dado massas molares: Mg = 24 g mol-1 , O = 16 g mol-1 , C = 12 g mol-1
Nessa análise, a absortividade do analito, em L g-1 cm-1 , é