Questões da Prova FGV - 2010 - FIOCRUZ - Tecnologista em Saúde - Flexografia
Foram encontradas 43 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
I. Os resultados não devem atender aos critérios de aceitação.
II. Desvios e resultados fora dos limites devem ser investigados pela empresa.
III. Se os desvios forem aceitos, devem ser justificados.
IV. Quando necessário, devem ser conduzidos estudos adicionais.
Assinale:
I. O equipamento deve estar visualmente limpo.
II. Qualquer agente ativo do produto após a limpeza deve estar presente em níveis máximos de 10 ppm ou 10 mg/g do produto após a limpeza em relação ao produto subseqüente.
III. Qualquer agente ativo do produto após a limpeza deve estar presente em níveis máximos de 1/100 da dose mínima diária da substância ativa em relação à dose máxima diária do produto subseqüente, calculado de acordo com a equação seguinte (LeBlanc, 1999):
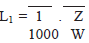
Onde:
L1 = Limite no produto subseqüente em mg/g
Z = Dose mínima diária do produto a ser limpo
Assinale: