Questões de Concurso Sobre cinética e cálculo de reatores em engenharia química e química industrial
Foram encontradas 187 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Ano: 2018
Banca:
CESGRANRIO
Órgão:
Petrobras
Prova:
CESGRANRIO - 2018 - Petrobras - Engenheiro de Processamento Júnior |
Q1090849
Engenharia Química e Química Industrial
As reações químicas podem ter a velocidade de reação
modificada com a temperatura. Assim, Arrhenius propôs
uma formulação levando em consideração a energia de
ativação e o fator de frequência. Um composto a 20°C
possui uma constante de velocidade igual a 5x10-4/s e
possui a energia de ativação 100 kJ/mol.
Se a decomposição desse composto ocorre a 27°C, o valor aproximado da constante de velocidade, em s-1, é
Dados R = 8,31 J/mol.K ln (5x10-4 ) = -7,6
Se a decomposição desse composto ocorre a 27°C, o valor aproximado da constante de velocidade, em s-1, é
Dados R = 8,31 J/mol.K ln (5x10-4 ) = -7,6
Ano: 2018
Banca:
CESGRANRIO
Órgão:
Petrobras
Prova:
CESGRANRIO - 2018 - Petrobras - Engenheiro de Processamento Júnior |
Q1090848
Engenharia Química e Química Industrial
Um pesquisador em seu laboratório realizou uma reação
química entre dois elementos X e Y. As velocidades iniciais das reações foram colocadas na Tabela abaixo.
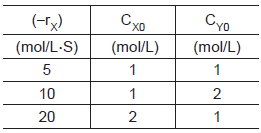
Com base nos dados da Tabela, a equação da velocidade pode ser

Com base nos dados da Tabela, a equação da velocidade pode ser
Ano: 2018
Banca:
CESGRANRIO
Órgão:
Petrobras
Prova:
CESGRANRIO - 2018 - Petrobras - Engenheiro de Processamento Júnior |
Q1090808
Engenharia Química e Química Industrial
Em um sistema de descarbonatação, uma corrente gasosa de 200 kg h-1, contendo 22% m/m de CO2, é borbulhada em uma solução aquosa de Ca(OH)2
.
Sendo o rendimento da reação igual a 90%, a taxa de formação de CaCO3, em kg h-1 , corresponde a
Dados Massa molar do CO2 : 44 g mol-1 Massa molar do CaCO3 : 100 g mol-1
Sendo o rendimento da reação igual a 90%, a taxa de formação de CaCO3, em kg h-1 , corresponde a
Dados Massa molar do CO2 : 44 g mol-1 Massa molar do CaCO3 : 100 g mol-1
Ano: 2018
Banca:
CESGRANRIO
Órgão:
Transpetro
Prova:
CESGRANRIO - 2018 - Transpetro - Engenheiro Júnior - Processamento (Químico) |
Q1090299
Engenharia Química e Química Industrial
Uma indústria de produtos alimentícios possui um reator
do tipo CSTR em um processo de mistura intensa. A
função desse reator é processar a reação de hidrólise do
anidrido acético (1a
ordem em anidrido) com excesso de
água a 25 °C e 1 atm. Essa reação está expressa abaixo:
C4H6O3 + H2 O → 2 CH3COOH
A reação deverá produzir 20 kg/h de ácido acético, a constante de velocidade é aproximadamente 0,05 min-1 , a concentração inicial de anidrido acético é de 100 g/L, e a conversão, de 80%.
O volume aproximado, em litros, desse reator é
Dados Massa Molar do Ácido Acético (CH3COOH) = 60 g/mol Massa Molar do Anidrido Acético (C4H6O3 ) = 102 g/mol
C4H6O3 + H2 O → 2 CH3COOH
A reação deverá produzir 20 kg/h de ácido acético, a constante de velocidade é aproximadamente 0,05 min-1 , a concentração inicial de anidrido acético é de 100 g/L, e a conversão, de 80%.
O volume aproximado, em litros, desse reator é
Dados Massa Molar do Ácido Acético (CH3COOH) = 60 g/mol Massa Molar do Anidrido Acético (C4H6O3 ) = 102 g/mol
Ano: 2018
Banca:
CESGRANRIO
Órgão:
Transpetro
Prova:
CESGRANRIO - 2018 - Transpetro - Engenheiro Júnior - Processamento (Químico) |
Q1090296
Engenharia Química e Química Industrial
Em um reator é realizada a hidrogenação de C2H4
. Esse
reator é alimentado por duas correntes: uma com vazão
de 56 kg h-1 de C2H4
e outra com vazão de 10 kg h-1 de
H2. O processo opera em estado estacionário, e, na saída
do reator, verifica-se que apenas o reagente limitante foi
consumido por completo.
Em uma etapa posterior, o reagente em excesso que não participou da reação é recuperado, sendo completamente separado do produto formado. A vazão de reagente recuperado, em kg h-1, é igual a
Dado Massas molares: C2H4 : 28 g mol-1, H2 : 2g mol-1
Em uma etapa posterior, o reagente em excesso que não participou da reação é recuperado, sendo completamente separado do produto formado. A vazão de reagente recuperado, em kg h-1, é igual a
Dado Massas molares: C2H4 : 28 g mol-1, H2 : 2g mol-1