Questões de Concurso Comentadas sobre química para copese - ufpi
Foram encontradas 18 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Na sequência o iodo foi titulado com tiossulfato de sódio a 0,100 mol/L até o ponto final, com o gasto de 30,00 mL de titulante. Esta última reação foi: I2 + 2 S2O2-3(aq) ➝ 2 I-(aq) + S4O2-6(aq).
Diante das informações, assinale a opção que mostra A PORCENTAGEM EM MASSA DE ZINCO NA AMOSTRA de latão: Dados: massas molares (g/mol): Cu = 63,5; Zn = 65,4.
I. A uma temperatura fixa, uma solução aquosa saturada de um determinado soluto sempre contém uma quantidade fixa desse soluto;
II. Todos os líquidos fervem a uma temperatura superior ao seu ponto de ebulição normal quando contêm impurezas não voláteis;
III. Toda solução comporta-se como uma solução ideal.
Com base na análise dos itens I, II e III, assinale a opção CORRETA:
Tabela: Dados obtidos na investigação cinética (método da velocidade inicial) para a reação: 2 A2B(g) → 2 A2(g) + B2(g).
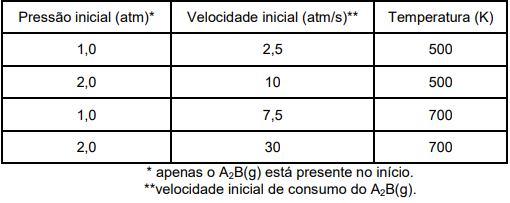
Diante das informações acima, assinale a opção que mostra A VELOCIDADE DA REAÇÃO (em termos de consumo do A2B(g)), em atm/s, quando a pressão de A2B(g) é igual a 1,5 atm à temperatura de 600 K:
Diante das informações e a partir dos seus conhecimentos, assinale a opção que mostra aproximadamente O VALOR DO pOH de uma solução de pH 8,50, a 37 °C:
Dados: densidade da água = 1000 g/L; massa molar da água = 18 g/mol; log(1,73) = 0,24; log(3) = 0,48.