Considere o seguinte experimento mental: Um recipiente r...
Um recipiente retangular de volume total V, hermeticamente fechado e de paredes externas adiabáticas, possui internamente três compartimentos também herméticos. Esse recipiente hipotético possui um mecanismo que permite que as paredes internas que separam os compartimentos hora funcionem como paredes adiabáticas, hora como diatérmicas. Cada compartimento é preenchido com uma porção de massa M de um gás ideal, aquecida a diferentes temperaturas, sendo T temperatura a do gás no compartimento 1; 2T do gás no compartimento 2 e 0,75T do gás no compartimento 3. Inicialmente as paredes que separam os compartimentos 1 e 3 e os compartimentos 3 e 2 funcionam como paredes diatérmicas e a parede que separa o compartimento 1 e 2 funciona como uma parede adiabática. Após um tempo suficiente de espera os gases armazenados entram em equilíbrio termodinâmico. Dá-se início à segunda etapa do experimento, em que os tipos de parede se invertem: as paredes entre os compartimentos 1 e 3 e entre os compartimentos 2 e 3 passam, então, a funcionar como paredes adiabáticas, e a parede entre o compartimento 1 e 2, como diatérmica. Como esquematizado na ilustração abaixo:
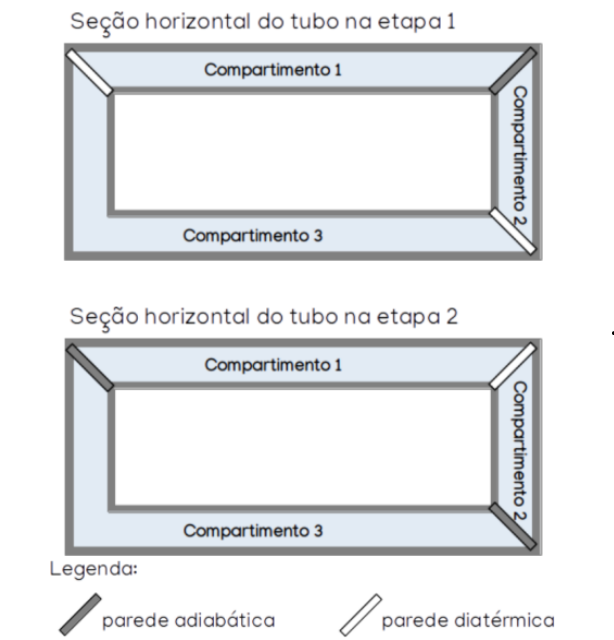
Figura 1. Ilustração esquemática dos compartimentos nas duas etapas do experimento
Sobre os processos termodinâmicos ocorridos com os gases nos compartimentos, analise as afirmativas abaixo.
I. Na etapa 2 do experimento, não haverá troca de calor entre os gases do compartimento 1 e 2. II. Na etapa 1 do experimento, os processos termodinâmicos ocorridos com os gases nos compartimentos de 1 a 3 são todos isobáricos. III. Na etapa 1 do experimento há um aumento da energia interna do gás localizado no compartimento 3 e, portanto, um aumento do trabalho que esse gás realiza sobre as paredes.
Assinale a alternativa que versa sobre a veracidade das afirmativas acima. Se necessário considere a Lei dos Gases Ideais: pV=nRT.
Gabarito comentado
Confira o gabarito comentado por um dos nossos professores
Clique para visualizar este gabarito
Visualize o gabarito desta questão clicando no botão abaixo