Questões de Concurso Público UFSM 2022 para Técnico de Laboratório - Química
Foram encontradas 28 questões
A dureza da água é definida pela quantidade de alguns íons dissolvidos, como carbonatos, sulfatos, cálcio e magnésio. Para a determinação da dureza total, faz-se necessária a determinação destes íons de maneira seletiva. Como exemplo, a determinação de íons Ca2+ em águas envolve com frequência a titulação complexométrica com o reagente etilenodiaminotetra-acetato dissódico (Na2 EDTA).
Com esse propósito, um químico preparou uma solução do sal Na2EDTA di-hidratado (peso molecular = 372,0 g) pela dissolução de 0,140 g em 250 mL de água desionizada.
Com relação a essa solução preparada, qual sua concentração molar (mol/L)?
( ) O eletrodo combinado possui dois eletrodos de referência (Ag/AgCl) que medem a diferença de potencial elétrico por meio da membrana de vidro.
( ) O eletrodo combinado possui um bulbo de vidro com um anel externo de prata metálica (Ag) sensível a íons H+.
( ) O termo eletrodo de vidro combinado é sinônimo de eletrodo de vidro, tendo a mesma estrutura e funcionamento.
( ) As principais interferências para esse tipo de eletrodo são os íons metálicos alcalinos, como o Na+, Li+ e K+.
A sequência correta é
O ácido fosfórico é um reagente amplamente utilizado nas indústrias alimentícias, têxtil e metalúrgica. Na fabricação de fertilizantes, o H3PO4 também é frequentemente empregado na produção de superfosfatos. Em laboratórios de análises químicas, o H3PO4 é frequentemente utilizado para o preparo de soluções aquosas destinadas à realização de um grande número de procedimentos. Esse ácido se dissocia em água de acordo com as seguintes reações de hidrólise:
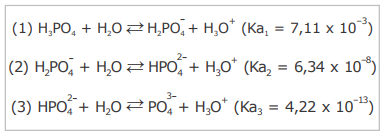
A partir das reações demonstradas acima, considere as seguintes afirmativas.
I - A partir da dissociação do H3PO4, três bases conjugadas são formadas na solução em equilíbrio químico.
II - A etapa (3) de dissociação libera a maior concentração de íons hidrônio (H3O+) na solução em equilíbrio químico.
III - A concentração do ânion 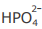 é maior que a concentração do ânion
é maior que a concentração do ânion 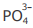 na solução em equilíbrio 4
químico.
na solução em equilíbrio 4
químico.
IV - A concentração do ânion 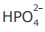 é maior que a concentração do ânion
é maior que a concentração do ânion 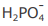 na solução em equilíbrio químico.
na solução em equilíbrio químico.
Estão corretas