Questões de Concurso Público UFPR 2018 para Químico
Foram encontradas 40 questões
Q925958
Química
Qual é a massa, em gramas, de NaCl necessária para precipitar todos os íons prata presentes em 15,0 mL de solução de
0,125 mol L-1 de AgNO3?
(Massas molares (g mol-1
): Na = 23; Cl = 35,5; Ag = 108; N = 14; O = 16)
Q925959
Química
A fermentação da glicose (C6H12O6) produz etanol (C2H6O) e dióxido de carbono (CO2), conforme a equação química não
balanceada abaixo:
C6H12O6(aq) → C2H6O(aq) + CO2(g)
(Massas molares (g mol-1 ): C = 12; H = 1; O = 16)
Qual é a massa, em gramas, de CO2 produzida quando 0,400 mol de glicose reage dessa maneira?
C6H12O6(aq) → C2H6O(aq) + CO2(g)
(Massas molares (g mol-1 ): C = 12; H = 1; O = 16)
Qual é a massa, em gramas, de CO2 produzida quando 0,400 mol de glicose reage dessa maneira?
Q925960
Química
A concentração de ferro em minérios pode ser determinada por titulação de uma amostra com uma solução de
permanganato de potássio. O minério é dissolvido em ácido clorídrico, levando à formação de íons Fe(II) que reagem com
o íon permanganato de acordo com a seguinte equação:
5 Fe2+(aq) + MnO4-(aq) + 8 H+(aq) → 5 Fe3+(aq) + Mn2+(aq) + 8 H2O(aq)
O ponto estequiométrico é atingido quando todo o Fe2+ reagiu, e a detecção é feita quando a cor característica da solução contendo íons MnO4- persiste. Para dissolver uma amostra de 202 mg de minério em ácido clorídrico, foram necessários 16,7 mL de uma solução 1,08 x 10-2 mol L-1 de KMnO4 para atingir o ponto estequiométrico. Qual é a porcentagem em massa de ferro na amostra?
5 Fe2+(aq) + MnO4-(aq) + 8 H+(aq) → 5 Fe3+(aq) + Mn2+(aq) + 8 H2O(aq)
O ponto estequiométrico é atingido quando todo o Fe2+ reagiu, e a detecção é feita quando a cor característica da solução contendo íons MnO4- persiste. Para dissolver uma amostra de 202 mg de minério em ácido clorídrico, foram necessários 16,7 mL de uma solução 1,08 x 10-2 mol L-1 de KMnO4 para atingir o ponto estequiométrico. Qual é a porcentagem em massa de ferro na amostra?
Q925961
Química
Equilíbrios químicos são fenômenos comuns às reações químicas. Em poucas palavras, numa reação que tende ou que
já atingiu o equilíbrio, os reagentes se convertem em produtos e os produtos regeneram os reagentes, sendo que a
posição equilíbrio pode ser determinada a partir da constante de equilíbrio (Keq), que leva em consideração a
concentração, no equilíbrio, das espécies envolvidas. Considere que uma reação química genérica atingiu o equilíbrio
químico e que a equação da constante de equilíbrio dessa reação é a apresentada a seguir:
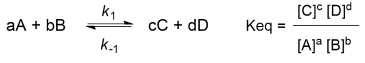
Assumindo que as equações acima são modelos que podem ser aplicados a qualquer reação química, é correto afirmar que, no equilíbrio:
1. as concentrações de A, B, C e D são iguais. 2. as concentrações de A, B, C e D não se alteram com o tempo. 3. a reação para de acontecer, logo, a formação de produtos é interrompida. 4. a constante de velocidade da reação direta (k1) é igual à da reação inversa (k-1).
Assinale a alternativa correta.
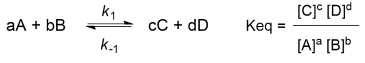
Assumindo que as equações acima são modelos que podem ser aplicados a qualquer reação química, é correto afirmar que, no equilíbrio:
1. as concentrações de A, B, C e D são iguais. 2. as concentrações de A, B, C e D não se alteram com o tempo. 3. a reação para de acontecer, logo, a formação de produtos é interrompida. 4. a constante de velocidade da reação direta (k1) é igual à da reação inversa (k-1).
Assinale a alternativa correta.
Q925962
Química
Os ácidos e bases são importantes em diversos processos químicos que ocorrem ao nosso redor, desde os industriais
até os biológicos. Essas substâncias foram primeiro identificadas pelas propriedades de suas soluções aquosas.

Considerando a dissociação de um ácido genérico (HA) em água, conforme a equação mostrada acima, identifique como verdadeiras (V) ou falsas (F) as seguintes afirmativas:
( ) Se HA = HCl, ele estará completamente dissociado e a [H3O+ ] = [HCl]inicial. ( ) HA é o ácido conjugado da H2O enquanto H3O+ é o ácido conjugado de A- . ( ) HA é um ácido de Bronsted-Lowry e H2O é uma base de Bronsted-Lowry. ( ) Se HA = ácido acético, ele estará completamente dissociado e a [H3O+ ] = [ácido acético]inicial.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.

Considerando a dissociação de um ácido genérico (HA) em água, conforme a equação mostrada acima, identifique como verdadeiras (V) ou falsas (F) as seguintes afirmativas:
( ) Se HA = HCl, ele estará completamente dissociado e a [H3O+ ] = [HCl]inicial. ( ) HA é o ácido conjugado da H2O enquanto H3O+ é o ácido conjugado de A- . ( ) HA é um ácido de Bronsted-Lowry e H2O é uma base de Bronsted-Lowry. ( ) Se HA = ácido acético, ele estará completamente dissociado e a [H3O+ ] = [ácido acético]inicial.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.