Questões de Concurso Público INB 2018 para Engenheiro Químico
Foram encontradas 4 questões
Ano: 2018
Banca:
FUNDEP (Gestão de Concursos)
Órgão:
INB
Prova:
FUNDEP (Gestão de Concursos) - 2018 - INB - Engenheiro Químico |
Q1103491
Engenharia Química e Química Industrial
Areação do óxido nítrico com hidrogênio ocorre conforme
a equação química a seguir.
2H2 (g) + 2NO (g) → N2(g) + 2H2O (g)
Para compreender a velocidade da reação química em função das concentrações dos reagentes, um técnico realizou os seguintes experimentos.
Experimento 1 – Quando dobrou a concentração do gás hidrogênio e reduziu à metade a concentração do óxido nítrico, a velocidade da reação dobrou.
Experimento 2 – Quando quadruplicou a concentração do gás hidrogênio e dobrou a concentração do óxido nítrico, a velocidade da reação química quadruplicou.
A partir dessas informações, é correto afirmar que a expressão matemática da Lei de Velocidade é representada por:
2H2 (g) + 2NO (g) → N2(g) + 2H2O (g)
Para compreender a velocidade da reação química em função das concentrações dos reagentes, um técnico realizou os seguintes experimentos.
Experimento 1 – Quando dobrou a concentração do gás hidrogênio e reduziu à metade a concentração do óxido nítrico, a velocidade da reação dobrou.
Experimento 2 – Quando quadruplicou a concentração do gás hidrogênio e dobrou a concentração do óxido nítrico, a velocidade da reação química quadruplicou.
A partir dessas informações, é correto afirmar que a expressão matemática da Lei de Velocidade é representada por:
Ano: 2018
Banca:
FUNDEP (Gestão de Concursos)
Órgão:
INB
Prova:
FUNDEP (Gestão de Concursos) - 2018 - INB - Engenheiro Químico |
Q1103493
Engenharia Química e Química Industrial
Uma mistura de 40% e 60% em massa de CaCO3
e
MgCO3
, respectivamente, foi calcinada, formando óxidos
de cálcio e magnésio e dióxido de carbono.
Considerando que foram produzidos 22 gramas do CO2
,
é correto afirmar:
Ano: 2018
Banca:
FUNDEP (Gestão de Concursos)
Órgão:
INB
Prova:
FUNDEP (Gestão de Concursos) - 2018 - INB - Engenheiro Químico |
Q1103498
Engenharia Química e Química Industrial
A ligação peptídica é a ligação que se estabelece quando ocorre reação entre dois aminoácidos, conforme a equação
química descrita a seguir. 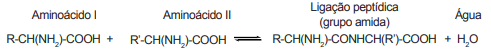 Considere que 2 mols de molécula do aminoácido I são adicionados para reagir com 1 mol de molécula do aminoácido II.
Quando o equilíbrio químico é estabelecido (equilíbrio 1), 20% do aminoácido I é consumido. Em seguida, adicionou-se
certa quantidade de mols de molécula do aminoácido II, e 10% do aminoácido I foi consumido até reestabelecer um novo
equilíbrio (equilíbrio 2).
Nessas condições, qual é a razão aproximada entre o primeiro e segundo equilíbrios?
Considere que 2 mols de molécula do aminoácido I são adicionados para reagir com 1 mol de molécula do aminoácido II.
Quando o equilíbrio químico é estabelecido (equilíbrio 1), 20% do aminoácido I é consumido. Em seguida, adicionou-se
certa quantidade de mols de molécula do aminoácido II, e 10% do aminoácido I foi consumido até reestabelecer um novo
equilíbrio (equilíbrio 2).
Nessas condições, qual é a razão aproximada entre o primeiro e segundo equilíbrios?
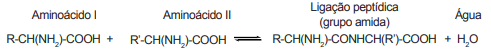 Considere que 2 mols de molécula do aminoácido I são adicionados para reagir com 1 mol de molécula do aminoácido II.
Quando o equilíbrio químico é estabelecido (equilíbrio 1), 20% do aminoácido I é consumido. Em seguida, adicionou-se
certa quantidade de mols de molécula do aminoácido II, e 10% do aminoácido I foi consumido até reestabelecer um novo
equilíbrio (equilíbrio 2).
Nessas condições, qual é a razão aproximada entre o primeiro e segundo equilíbrios?
Considere que 2 mols de molécula do aminoácido I são adicionados para reagir com 1 mol de molécula do aminoácido II.
Quando o equilíbrio químico é estabelecido (equilíbrio 1), 20% do aminoácido I é consumido. Em seguida, adicionou-se
certa quantidade de mols de molécula do aminoácido II, e 10% do aminoácido I foi consumido até reestabelecer um novo
equilíbrio (equilíbrio 2).
Nessas condições, qual é a razão aproximada entre o primeiro e segundo equilíbrios?
Ano: 2018
Banca:
FUNDEP (Gestão de Concursos)
Órgão:
INB
Prova:
FUNDEP (Gestão de Concursos) - 2018 - INB - Engenheiro Químico |
Q1103502
Engenharia Química e Química Industrial
Os principais poluentes atmosféricos são gases tóxicos
lançados pelas indústrias e pelos veículos automotivos
movidos por derivados do petróleo. Muitos gases tóxicos
provenientes das indústrias são desprendidos das
chaminés. Um processo utilizado para retirar SO2
das
emissões de fábricas é passar os gases produzidos,
juntamente com ar, por uma emulsão úmida de carbonato
de cálcio (CaCO3
). Nesse processo, todo o sulfato
de cálcio fica retido na cavidade interna da chaminé
e, posteriormente, é retirado nos procedimentos de
manutenção. A equação química a seguir representa o
processo químico.
CaCO3 (s) + SO2 (g) + ½O2 (g) → CaSO4 (s) + CO2 (g)
Considere, em um sistema ideal, que uma chaminé recebeu 2,4 x 1019 moléculas de SO2 que foram misturadas com 10 g do carbonato de cálcio. Nessas condições, quantos miligramas, aproximadamente, de sulfato de cálcio ficariam retidos na chaminé?
Considere, em um sistema ideal, que uma chaminé recebeu 2,4 x 1019 moléculas de SO2 que foram misturadas com 10 g do carbonato de cálcio. Nessas condições, quantos miligramas, aproximadamente, de sulfato de cálcio ficariam retidos na chaminé?
