Questões de Concurso Público SEE-PE 2016 para Professor de Química
Foram encontradas 6 questões
Um técnico preparou em um balão volumétrico 250 mL de uma solução diluída de ácido clorídrico (a 20ºC), pipetando adequadamente 8,4 mL do ácido concentrado 37% m/m de densidade 1,19 g.cm-3 (a 20ºC).
A concentração da solução preparada, em mol.L-1 é de, aproximadamente,
Dados: Massas molares: H = 1g.mol-1 Cl = 35,5 g.mol-1
Para quantificar sulfato em uma amostra adequadamente preparada foi elaborada uma curva de calibração a partir da diluição de uma solução padrão com concentração 100,0 mg.L-1 . A curva de calibração utilizou as seguintes soluções:
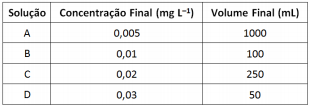
Sobre as soluções preparadas são feitas as afirmativas a seguir.
I. Para preparar as soluções A e C foram utilizados os mesmos volumes da solução padrão.Sobre as soluções preparadas são feitas as afirmativas a seguir.
II. Para preparar a solução B foi utilizado o menor volume da solução padrão.
III. Para preparar a solução D foi utilizado o maior volume da solução padrão.
Está correto o que se afirma em
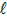 : 74,5; BaSO4: 233
: 74,5; BaSO4: 233Na determinação do teor de acidez de uma amostra de suco de laranja comercial, 10,00 mL de amostra foram levados para erlenmeyer. Adicionou-se água destilada até completar cerca de 50 mL, 3 gotas de fenolftaleína e titulou-se contra solução padrão de NaOH até mudança de coloração. Na titulação, foram gastos 3,90 mL de solução padrão 0,100 mol.L-1.
A acidez é expressa em termos do teor (porcentagem massa/volume) de ácido cítrico, cuja fórmula estrutural é apresentada a seguir.
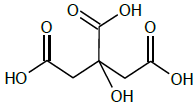
Assinale a opção que expressa a acidez da amostra.
Dados. Massa molar. Ácido Cítrico: 192 g.mol-1.