Questões de Concurso Público Petrobras 2018 para Químico de Petróleo Júnior
Foram encontradas 4 questões
É muito comum encontrar as substâncias KNO3 , NaOH, e HCℓ em produtos comercializados e de uso cotidiano.
Observe as afirmações a seguir concernentes a propriedades dessas substâncias
I - NaNO3 , ao ser dissolvido em água, altera significantemente o pH.
II - NaOH se dissocia parcialmente quando dissolvido em água, sendo, por isso, uma base fraca.
III - HCℓ é um gás muito solúvel em água, onde se dissocia diminuindo o pH.
Está correto APENAS o que se afirma em
Um resíduo aquoso, de volume igual a 30,0 L, contém dissolvidos 1,0 × 10-2 mol L-1 de Pb2+ e 2,0 × 10-2 mol L-1 de Hg22+. Esses íons foram precipitados com a adição de uma solução aquosa de ácido sulfúrico 1,0 mol L-1 , de acordo com as equações a seguir, em volume suficiente para garantir excesso de sulfato.
Pb2+ (aq) + SO4 2- (aq) → PbSO4 (s)
Hg2 2+ (aq) + SO4 2- (aq) → Hg2 SO4 (s)
A massa de precipitado, em gramas, que seria obtida, considerando a reação quantitativa, é mais próxima de
Dados
M (PbSO4 ) = 303 g mol-1
M (Hg2 SO4 ) = 497 g mol-1
Um volume de 500 mL de uma solução aquosa, contendo 0,0040 mol L-1 de Ba2+ foi misturada com 500 mL de uma solução 0,0060 mol L-1 de ácido sulfúrico, promovendo a reação conforme ilustrado na Equação I a seguir:
Ba2+ (aq) + H2SO4 (aq) → BaSO4 (s) + 2 H+ (aq) (Equação I)
O BaSO4 produzido se dissocia, estabelecendo um equilíbrio de solubilidade como indicado na Equação II a seguir:
BaSO4(aq) ⇋ Ba2+ (aq) + SO42- (aq) ; Kps = 1 x 10-9 (Equação II)
A solução resultante (de volume igual a 1000 mL) se encontra a 25°C. Conforme as condições indicadas, e ignorando a
influência da força iônica no equilíbrio de solubilidade, mas considerando o excesso de SO42- em solução, a concentração
aproximada de Ba2+ residual na solução, em mol L-1
, é
Na titulação fotométrica, com monitoramento da absorvância da solução em 330 nm, o analito A, em solução, reage com o reagente titulante T para formar o produto P de acordo com a equação a seguir:
A(aq) + T(aq) → P(aq)
A curva de titulação obtida é mostrada abaixo.
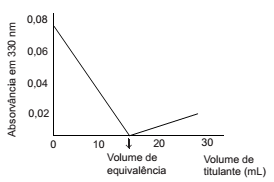
Com base nas informações acima, conclui-se que