Questões Militares Sobre propriedades coligativas: tonoscopia, ebulioscopia, crioscopia e pressão osmótica. em química
Foram encontradas 25 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Três frascos foram encontrados sem rótulo na bancada de um laboratório. Um deles continha solução de KOH a 0,1 mol/L; o outro, solução de CaCl2 a 0,05 mol/L; e o outro, solução de CH3CH2COOH a 0,1 mol/L. Na tentativa de identificar a solução contida em cada um deles, um técnico usou volumes iguais das soluções dos frascos para medir a pressão de vapor sob mesma temperatura, utilizando um sistema adequado. Os resultados obtidos estão indicados pelos ponteiros dos manômetros nesta figura.
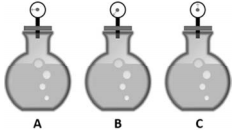
Com base nas informações e na figura apresentadas, é correto
afirmar que os frascos identificados por A, B e C contêm,
respectivamente, as soluções de
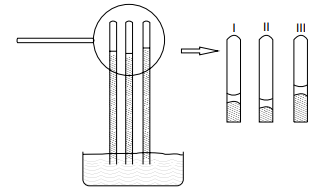
Nesse experimento, a água, a solução de cloreto de sódio e a solução de glicose estão contidas, respectivamente, nos tubos
(Dados: Kf = 1,86 ºC.kg.mol-1 ; M(g.mol-1 ): Cl = 35,5; Na = 23)
A diferença na temperatura de fusão (em °C) na mistura obtida ao se dissolver 200 g de sal de cozinha em 1 kg de água, em relação à água pura, é de:
CONSTANTES
Constante de Avogadro (NA) = 6,02 x 1023 mol-1
Constante de Faraday (F) = 9,65 x 104 C mol-1 = 9,65 x 104 A s mol-1 = 9,65 x 104 J V-1 mol-1
Volume molar de gás ideal = 22.4 L (CNTP)
Carga elementar = 1,602 x 10-19 C
Constante dos gases (R) = 8,21 x 10-2 atm L K -1 mol-1 = 8,31JK-1 mol-1 = 1,98 cal K-1 mol-1 =
= 62,4 mmHg L K-1 mol-1
Constante gravitacional (g) = 9,81 m s-2
Constante de Planck (h) = 6,626 x 10-34 m2kg s-1
Velocidade da luz no vácuo = 3,0x 108 ms-1
Número de Euler (e) = 2,72
DEFINIÇÕES
Pressão: 1 atm = 760mmHg = 1,01325 x 105 N m-2 = 760 Torr = 1,01325 bar
Energia: 1 J = 1N m = 1 kg m2 s-2
Condições normais de temperatura e pressão (CNTP): 0°C e 760 mmHg
Condições ambientes: 25° C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol L-1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (L) = líquido, (g) = gás. (aq) = aquoso. (CM) = circuito metálico, (conc) = concentrado.
(ua) = unidades arbitrárias. [X] = concentração da espécie química X em mol L-1

São feitas as seguintes proposições a respeito de propriedades coligativas:
I. A pressão osmótica depende do tipo de solvente para um dado soluto.
II. A criometria usa o abaixamento do ponto de congelamento do solvente para medir a massa molar do
soluto.
III. Na ebuliometria, a variação da temperatura de ebulição depende da concentração molal de soluto não volátil utilizado.
IV. Na tonometria, ocorre abaixamento da pressão de vapor de uma solução que contém um soluto não volátil, em relação ao solvente puro.
Das proposições acima é(são) CORRETA(S)