Questões Militares Sobre teoria atômica: modelo atômico de dalton, thomson, rutherford, rutherford-bohr em química
Foram encontradas 43 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
A tabela mostra a distribuição eletrônica, em níveis de energia, do átomo do gás nobre argônio, Ar.
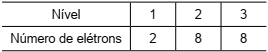
Dois dos íons que apresentam essa mesma distribuição eletrônica são:

Experimentos foram realizados, bombardeando cada material com uma quantidade de partículas a e registrando o número de partículas coletadas em cada detector, conforme a tabela abaixo.
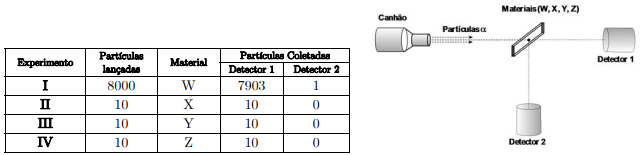
A partir dessas informações, assinale a alternativa que apresenta a conclusão CORRETA sobre as observações feitas nos experimentos.
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

(1) A intensidade da luz depende da frequência ou do comprimento de onda da radiação empregada. (2) Dentre as cores do espectro visível, a azul é a que possui maior intensidade devido ao seu menor comprimento de onda. (3) Dentro do espectro visível, a luz vermelha é a radiação que possui o menor comprimento de onda. (4) O estado do elétron em um átomo é completamente definido pelos números quânticos n, l, ml . (5) A configuração eletrônica dos átomos é determinada pelo princípio da construção, pelo princípio da exclusão de Pauli e pela regra de Hund. (6) Na tabela periódica, os pares de elementos com relação diagonal geralmente exibem propriedades químicas semelhantes.
A soma dos números associados às sentenças ERRADAS é igual a
Esse experimento refere-se ______ e à emissão de ______ .
Assinale a alternativa que completa, correta e respectivamente, as lacunas.
CIENTISTAS
I- Dalton II- Thomson III Rutherford IV- Chadwick
DESCOBERTAS
( ) Descobriu os nêutrons em 1932, durante experiências com material radioativo. ( )Foi o primeiro modelo científico para o átomo e era semelhante a uma bola de bilhar. ( )Propôs um modelo atómico semelhante a pudim de passas. ( )Criou um modelo atomico semelhante à disposição dos planetas no sistema solar
