Questões Militares
Foram encontradas 603 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
http://www.crianca.mppr.mp.br/2020/03/233/ESTATISTICAS-Estupro-bate-recorde-e-maioria-das-vitimas-sao-meninas-de-ate-13-anos.html Acesso em 23/06/2020.
Para indicar a presença de esperma, que pode ser encontrado em um crime sexual, podem ser feitos dois testes simples em uma amostra recolhida do fluido biológico da vítima: uma reação utiliza o reativo de Florence, constituído por I2, KI e H2O; a outra, uma solução saturada de ácido pícrico (C6H3N3O7) em glicerina (C3H8O3). Nas duas reações, a presença do esperma é observada devido ao aparecimento de uma coloração amarelada. Embora exista a possibilidade de falsos positivos, estes testes podem ajudar a identificar indícios. A natureza das ligações químicas que formam as substâncias utilizadas nos testes permite classificá-las, respectivamente, como
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

(1) A intensidade da luz depende da frequência ou do comprimento de onda da radiação empregada. (2) Dentre as cores do espectro visível, a azul é a que possui maior intensidade devido ao seu menor comprimento de onda. (3) Dentro do espectro visível, a luz vermelha é a radiação que possui o menor comprimento de onda. (4) O estado do elétron em um átomo é completamente definido pelos números quânticos n, l, ml . (5) A configuração eletrônica dos átomos é determinada pelo princípio da construção, pelo princípio da exclusão de Pauli e pela regra de Hund. (6) Na tabela periódica, os pares de elementos com relação diagonal geralmente exibem propriedades químicas semelhantes.
A soma dos números associados às sentenças ERRADAS é igual a
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

(1) O ponto de fusão do argônio é menor que o do xenônio em uma mesma pressão. (2) A pressão de vapor do dimetilpropano é maior que a do pentano. (3) O valor absoluto da energia potencial de interação entre a molécula de água e o Ca2+ é menor do que entre a molécula de água e o Al3+ . (4) O valor absoluto da energia potencial de interação entre a molécula de água e o Ga3+ é maior do que entre a molécula de água e o Al3+ .
A soma dos números associados às proposições ERRADAS é igual a
Considere os dados apresentados na tabela.
Regiões da atmosfera Densidade do ar kg.m–3 Temperatura °C Pressão atm
troposfera 1 17 1
mesosfera 7 x 10–6 –83 X
(Bottecchia, O.L. Química Nova. Adaptado)
Considerando que a massa molar do ar em toda a atmosfera é aproximadamente constante, 29 g.mol–1, o valor
da pressão atmosférica na mesosfera, X, na temperatura
indicada na tabela é aproximadamente
Assinale a alternativa que completa, correta e respectivamente, as lacunas.
Esse experimento refere-se ______ e à emissão de ______ .
Assinale a alternativa que completa, correta e respectivamente, as lacunas.
Com relação às características eletrônicas do arsênico (número atômico 33), assinale (V) para a afirmativa verdadeira e (F) para a falsa. ( ) Possui elétrons distribuídos em três níveis eletrônicos. ( ) Seu elétron de maior energia ocupa o nível P. ( ) Possui cinco elétrons na camada de valência.
As afirmativas são, segundo a ordem apresentada, respectivamente,

Os coeficientes que correspondem às letras x, y e z são, respectivamente:
I - Enxofre em pó e lascas de ferro.
lI - Agua e sal de cozinha.
lII - Sangue humano (glóbulos vermelhos e plasma) .
Assinale a opção que permite. respectivamente, a separação das misturas acima.
I- X pertence ao grupo dos metais alcalinos;
II- Y pertence ao grupo dos metais alcalinos terrosos;
III- Z pertence ao grupo dos gases nobres;
IV- X, Y e Z não pertencem ao mesmo período da tabela periódica.
Marque a opção correta.
CIENTISTAS
I- Dalton II- Thomson III Rutherford IV- Chadwick
DESCOBERTAS
( ) Descobriu os nêutrons em 1932, durante experiências com material radioativo. ( )Foi o primeiro modelo científico para o átomo e era semelhante a uma bola de bilhar. ( )Propôs um modelo atómico semelhante a pudim de passas. ( )Criou um modelo atomico semelhante à disposição dos planetas no sistema solar
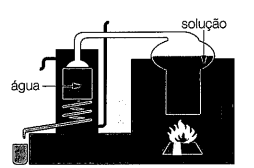
O processo de separação no qual se baseia o funcionamento do alambique é chamado de:
Uma pesquisa recente propõe a identificação de resíduos de armas de fogo por meio de marcadores luminescentes, formados por compostos de lantanídeos. Esses compostos, adicionados à parte interna da munição, espalham-se no chão, mãos e roupas, após o disparo de uma arma, podendo ser detectados com luz negra. Quatro cores podem ser aplicadas ao procedimento:

Sabe-se que a cor de um átomo resulta das transições de seus elétrons entre os subníveis de energia. A cor do lantanídeo cujos átomos apresentam nove elétrons em seu subnível de maior energia no estado fundamental é:

A reação química entre o dióxido de nitrogênio e a água acarreta a formação de uma mistura de dois ácidos, comumente empregada na produção de fertilizantes. A equação química a seguir representa essa reação.
2 NO2 + H2O → HNO2 + HNO3
Analisando apenas os compostos participantes da reação, o maior número de oxidação do nitrogênio corresponde a:
Com os uniformes cobertos de barro, os militares bombeiros estavam por todos os lados no mar de lama e detritos que arrasou a cidade de Brumadinho devido ao acidente da barragem ocorrido no ano de 2019. A lama de rejeito provocou um rastro de destruição ao longo do Rio Paraopeba. Segundo especialistas, em toda a extensão percorrida, a água do rio não tinha condições para o consumo humano e animal. Dentre vários contaminantes, encontraram-se metais em altas concentrações como ferro, cobre, manganês e cromo.
Sobre os metais citados no texto, aquele que, quando o átomo se encontra ionizado no estado de oxidação +2 apresentará a configuração eletrônica 1s2 2s2 2p6 3s2 3p6 3d5 é o: