Questões de Concurso Militar CIAAR 2017 para Primeiro Tenente - Engenharia Química
Foram encontradas 5 questões
A soda cáustica é o nome comercial dado ao composto hidróxido de sódio (NaOH). Este composto é largamente aplicado na indústria para a purificação de derivados de petróleo e de óleos vegetais. É também utilizado na fabricação de produtos de uso doméstico, como o sabão.
Dado: MM (NaOH) = 40,00g/mol, qual a concentração em quantidade de matéria de uma solução que foi
preparada dissolvendo-se 200,00g de hidróxido de sódio em água e completando-se para 2,00L de solução?
A Equação de Nernst, desenvolvida pelo químico e físico alemão Walther Hermann Nernst, é a relação quantitativa que permite calcular a força eletromotriz de uma pilha para concentrações de íons diferentes de uma unidade. Também é usada para cálculos em titulação de oxidação-redução.
A equação a 25°C pode ser escrita de forma reduzida como: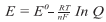
Sendo: R = 8,315 J K-1 mol-1; T = 298,2 K (25°C); F = 96485 C mol-1
Calcule a força eletromotriz para a seguinte pilha a 25°C: Fe / Fe2 + (0,02M) || Cu2
+(0,2M) / Cu
Dados: potencial padrão de redução (Eº Fe = -0,44V e Eº Cu = +0,40V).