Questões Militares de Química - Substâncias Inorgânicas: dissociação iônica e ionização, conceitos de ácido-base.
Foram encontradas 76 questões
A concentração em mol · L-1 dos íons sulfato ( SO
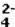 ) presentes na solução final é :
) presentes na solução final é :
pós a dissolução, as soluções contidas nas provetas 1 e 2 apresentam, respectivamente, caráter
Analise as afirmativas a seguir.
I. Ácido é toda substância que doa prótons.
II. Ácido é toda substância que recebe elétrons.
III. Ácido é toda substância que se ioniza em presença de água e origina, como um dos íons, o cátion H+ .
IV. Base é toda substância que recebe elétrons.
V. Base é toda substância que, em solução aquosa, sofre dissociação iônica, liberando o ânion OH– .
VI. Base é toda substância capaz de receber prótons.
Tratam da teoria de Bronsted-Lowry apenas as afirmativas
Uma solução aquosa de cloreto ferroso foi preparada pela dissolução de 25,4 gramas desse soluto em água suficiente para 500 mL de solução.
Admitindo-se que o grau de dissociação desse sal nesta solução é de 40%, a concentração de íons cloreto, em mol/L de solução, é igual a

Com base nestes dados, e sabendo que HA tem constante de ionização igual a 4,0 x 10−10, é coerente afirmar que o indicador HA
(Dado: log 4 = 0,6)