Questões Militares de Química - Equilíbrio Químico
Foram encontradas 47 questões
Considere as curvas de solubilidade.
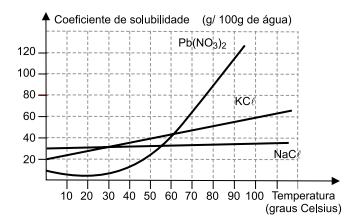
(Estudo gráfico do coeficiente de solubilidade – Manual da Química (manualdaquimica.com))
Ao preparar soluções aquosas com cada um dos sais,
separadamente, dissolvendo 10 g do sal em 50 g de
água a 40 ºC, observa-se formação de corpo de fundo
na solução de
Considere os seguintes pares de compostos:
I. HF e HI
II. NH3 e H2O
III. C2 H2 e C2 H4
Os compostos que apresentam maior acidez (menor valor de pKa) em I, II e III são, correta e respectivamente:
Em um experimento laboratorial, misturou-se 25 mL de uma solução aquosa de ácido clorídrico com concentração 0,8 mol L-1 com 25 mL de uma solução aquosa de hidróxido de sódio com concentração 0,6 mol L-1 .
Acerca do experimento, são feitas as seguintes afirmativas:
I – Trata-se de uma reação de neutralização.
II – A substância de caráter alcalino (básico) está em excesso estequiométrico.
III – A solução resultante após a reação possui caráter ácido.
IV – Após a reação, o pH da solução resultante possui valor igual a 2.
Das afirmativas feitas, estão corretas apenas
Visando estudar o equilíbrio a seguir, um experimentador adicionou quantidades equimolares de tricloreto de fósforo e cloro gasoso em um reator a 180 °C.
PCl3(g) + Cl2(g) ⇌ PCl5(g)
Atingido o equilíbrio, foi verificada uma concentração de 1 x 10−4 mol/L de pentacloreto de fósforo.
Admitindo que, a 180 °C, a constante do equilíbrio em apreço
seja igual a 0,64, assinale a opção que indica a concentração de
cloro gasoso presente no equilíbrio.