Questões Militares de Química - Eletroquímica: Oxirredução, Potenciais Padrão de Redução, Pilha, Eletrólise e Leis de Faraday.
Foram encontradas 49 questões
Considerando a constante de Faraday 9,65 x 104 C.mol–1 , a massa máxima de níquel e ouro depositadas nesse período de funcionamento do sistema foi, respectivamente, de, aproximadamente,
2 Na+(eletrólito) + 2 e– ➝ 2 Na(l) Eº = –2,71 V S8 (l) + 16 e– ➝ 8 S2– (eletrólito) Eº = –0,51 V
O potencial padrão dessa bateria e o número de elétrons transferidos para cada molécula S8 (l), são, respectivamente,
Num laboratório, um grupo de alunos possui quatro semicélulas montadas, todas em condição padrão de concentração e temperatura, correspondentes às semirreações mostradas no quadro abaixo:

Numa dada combinação para montar uma pilha eletroquímica, o valor de diferença de potencial (ΔE) da pilha, no instante em que se ligaram os contatos, foi de 0,69 V.
A combinação utilizada nessa pilha foi entre as semicélulas:
Quando a bateria está em uso (atuando como uma pilha), o anodo corresponde ao componente:
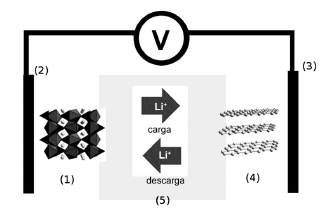
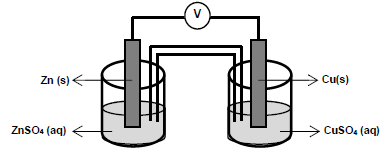
As semirreações que descrevem o processo de oxirredução estão descritas a seguir.
Cu2+ (aq) + 2e- → Cu(s) E0red = + 0,34 V (volts) Zn2+ (aq) + 2e- → Zn(s) E0red = - 0,76 V (volts)
Para o processo descrito, analise as afirmativas abaixo e dê valores Verdadeiro (V) ou Falso (F).
( ) O eletrodo de zinco sofre oxidação e o eletrodo de cobre sofre redução. ( ) A reação de oxidação ocorre no cátodo e reação de redução ocorre no ânodo. ( ) O diagrama de célula do processo é Zn (s)|Zn2+(aq)||Cu2+(aq)|Cu (s). ( ) Os elétrons fluem do ânodo para o cátodo. ( ) A reação global da pilha é Cu(s) + Zn2+(aq) → Cu2+(aq) + Zn(s) e a diferença de potencial é 1,10 V (volts).
Assinale a alternativa que apresenta a sequência correta de cima para baixo.
