Questões Militares de Química - Eletroquímica: Oxirredução, Potenciais Padrão de Redução, Pilha, Eletrólise e Leis de Faraday.
Foram encontradas 49 questões
A descrição correta desse ânodo
Em meados do século XX, as pilhas alcalinas surgiram como uma alternativa muito mais eficiente energeticamente em comparação às pilhas tradicionais. Como mostra a seguinte figura, a pilha alcalina utiliza os mesmos eletrodos da tradicional, porém o seu eletrólito é uma solução aquosa de hidróxido de sódio concentrada (~30% em massa) contendo uma dada quantidade de óxido de zinco ― daí a denominação alcalina para essa pilha.
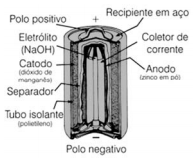
Internet:<http://qnesc.sbq.org.br> (com adaptações).
Diferentes marcas de telefones celulares buscam ganhar novos clientes, anunciando que a bateria de seus aparelhos é mais eficiente que a dos concorrentes, por manterem o telefone celular ligado por mais tempo. Quando descarregada, a bateria do celular é conectada a uma rede elétrica para que sua carga seja restabelecida.
Esse processo é um exemplo de:
Nestes últimos anos, os alunos da EsPCEx têm realizado uma prática no laboratório de química envolvendo eletrólise com eletrodos inertes de grafite. Eles seguem um procedimento experimental conforme a descrição:
- Num béquer de capacidade 100 mL (cuba eletrolítica) coloque cerca de 50 mL de solução aquosa de sulfato de zinco (ZnSO4) de concentração 1 mol·L-1. Tome como eletrodos duas barras finas de grafite. Ligue-as com auxílio de fios a uma fonte externa de eletricidade (bateria) com corrente de 2 Ampères. Esta fonte tem capacidade para efetuar perfeitamente esse processo de eletrólise. Uma das barras deve ser ligada ao polo negativo da fonte e a outra barra ao polo positivo da fonte. Mergulhe os eletrodos na solução durante 32 minutos e 10 segundos e observe.
Considere o arranjo eletrolítico (a 25 ºC e 1 atm), conforme visto na figura a seguir:
Dados: 1 Faraday (F) = 96500 Coulomb (C) / mol de elétrons
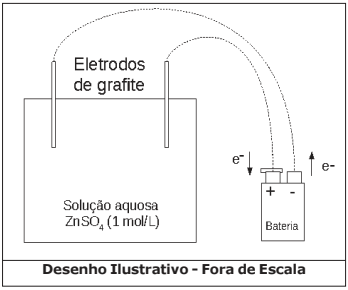
Acerca do experimento e os conceitos químicos envolvidos são feitas as seguintes afirmativas:
I – Na superfície da barra de grafite ligada como cátodo da eletrólise ocorre a eletrodeposição do zinco metálico.
II – A semirreação de oxidação que ocorre no ânodo da eletrólise é Zn (s) → Zn2+ (aq) + 2 e- .
III – Durante o processo a barra de grafite ligada ao polo positivo da bateria se oxida.
IV – No ânodo da eletrólise ocorre uma reação de oxidação da hidroxila com formação do gás oxigênio e água.
V – A massa de zinco metálico obtida no processo de eletrólise será de 0,83 g.
Das afirmativas feitas, estão corretas apenas
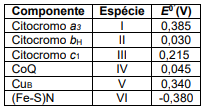
Respeitando o gradiente de energia livre, o fluxo de elétrons deve percorrer a sequência mostrada em: