Questões do Enem Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 55 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
CaCO3(s) + SO2 (g)
 CaS03(s) + CO2 (g) (1)
CaS03(s) + CO2 (g) (1)Por sua vez, o sulfito de cálcio formado pode ser oxidado, com o auxílio do ar atmosférico, para a obtenção do sulfato de cálcio, como mostrado na equação (2 ). Essa etapa é de grande interesse porque o produto da reação, popularmente conhecido como gesso, é utilizado para fins agrícolas.
2 CaSO3(s) + O2(g)
 2 CaS04(s) (2)
2 CaS04(s) (2)As massas molares dos elementos carbono, oxigênio, enxofre e cálcio são iguais a 12 g/mol, 16 g/mol, 32 g/mol e 40 g/mol, respectivamente.
BAIRD, C. Química ambiental. Porto Alegre: Bookman, 2002 (adaptado).
Considerando um rendimento de 90% no processo, a massa de gesso obtida, em gramas, por mol de gás retido é mais próxima de
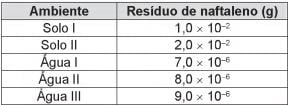
O ambiente que necessita de biorremediação é o(a)
LEE. J. D Química Inorgânica não tão concisa. São Paulo: Edgard Blucher. 1999 (adaptado).
Considerando que um forno foi alimentado com 2,5 toneladas de ferro-gusa, a massa de gás carbônico formada, em quilogramas, na produção de aço doce, é mais próxima de
Em um medicamento, a varfarina é administrada por via intravenosa na forma de solução aquosa, com concentração de 3,0 mg/mL. Um indivíduo adulto, com volume sanguíneo total de 5,0 L, será submetido a um tratamento com solução injetável desse medicamento.
Qual é o máximo volume da solução do medicamento que pode ser administrado a esse indivíduo, pela via intravenosa, de maneira que não ocorram hemorragias causadas pelo anticoagulante?
Disponível em: www.anvisa.gov.br. Acesso em: 1 ago. 2012 (adaptado).
Considerando-se o valor de 6 X 1023 mol-1 para a constante de Avogadro e a massa molar do cálcio igual a 40 g/mol, qual a quantidade mínima diária de átomos de cálcio a ser ingerida para que uma pessoa supra suas necessidades?