Questões do Enem
Foram encontradas 51 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Em meados de 2003, mais de 20 pessoas morreram no Brasil após terem ingerido uma suspensão de sulfato de bário utilizada como contraste em exames radiológicos. O sulfato de bário é um sólido pouquíssimo solúvel em água, que não se dissolve mesmo na presença de ácidos. As mortes ocorreram porque um laboratório farmacêutico forneceu o produto contaminado com carbonato de bário, que é solúvel em meio ácido. Um simples teste para verificar a existência de íons bário solúveis poderia ter evitado a tragédia. Esse teste consiste em tratar a amostra com solução aquosa de HCI e, após filtrar para separar os compostos insolúveis de bário, adiciona-se solução aquosa de H2SO4 sobre o filtrado e observa-se por 30 min.
TUBINO, M.; SIMONI, J. A. Refletindo sobre o caso Celobar®. Química Nova, n. 2, 2007 (adaptado).
A presença de íons bário solúveis na amostra é indicada pela
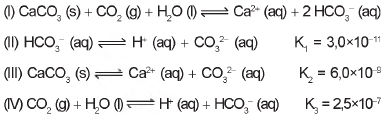
Com base nos valores das constantes de equilíbrio das reações II, III e IV a 25 “C, qual é o valor numérico da constante de equilíbrio da reação I?
MATEUS, A. L. Química na cabeça. Belo Horizonte: UFMG, 2001 (adaptado).
A explicação para o desaparecimento da cor rosa é que, com a combustão do palito de fósforo, ocorreu o(a)

A alteração da concentração de hemoglobina oxigenada no sangue ocorre por causa do(a)
O tubo de ensaio em que a enzima deve agir para indicar que a hipótese do pesquisador está correta é aquele que contém