Questões da Prova INEP - 2015 - ENEM - Exame Nacional do Ensino Médio - Primeiro e Segundo Dia
Foram encontradas 17 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
2 ZnS + 3 O2 → 2 ZnO + 2 S02
ZnO + CO → Z n + C02
Considere as massas molares: ZnS (97 g/mol); O2 (32 g/mol);ZnO (81 g/mol); SO2 (64 g/mol); CO (28 g/mol); CO2 (44 g/mol); e Zn (65 g/mol).
Que valor mais próximo de massa de zinco metálico,em quilogramas, será produzido a partir de 100 kg de esfalerita?
ANDRADE, C. D. Poesia completa e prosa. Rio de Janeiro: Aguilar, 1973 (fragmento).
Nesse fragmento de poema, o autor refere-se à bomba atômica de urânio. Essa reação é dita “em cadeia" porque na
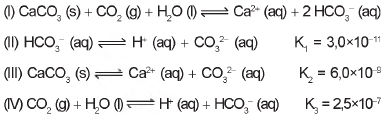
Com base nos valores das constantes de equilíbrio das reações II, III e IV a 25 “C, qual é o valor numérico da constante de equilíbrio da reação I?
MATEUS, A. L. Química na cabeça. Belo Horizonte: UFMG, 2001 (adaptado).
A explicação para o desaparecimento da cor rosa é que, com a combustão do palito de fósforo, ocorreu o(a)
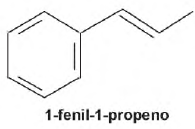
Os produtos obtidos na oxidação do alceno representado, em solução aquosa de KMnO4, são: