Questões ENEM de Química - Eletroquímica: Oxirredução, Potenciais Padrão de Redução, Pilha, Eletrólise e Leis de Faraday.
Foram encontradas 35 questões
Iniciativas do poder público para prevenir o uso de bebidas alcoólicas por motoristas, causa de muitos acidentes nas estradas do país, trouxeram à ordem do dia, não sem suscitar polêmica, o instrumento popularmente conhecido como bafômetro. Do ponto de vista de detecção e medição, os instrumentos normalmente usados pelas polícias rodoviárias do Brasil e de outros países utilizam o ar que os “suspeitos” sopram para dentro do aparelho, através de um tubo descartável, para promover a oxidação do etanol a etanal. O método baseia-se no princípio da pilha de combustível: o etanol é oxidado em meio ácido sobre um disco plástico poroso coberto com pó de platina (catalisador) e umedecido com ácido sulfúrico, sendo um eletrodo conectado a cada lado desse disco poroso. A corrente elétrica produzida, proporcional à concentração de álcool no ar expirado dos pulmões da pessoa testada, é lida numa escala que é proporcional ao teor de álcool no sangue. O esquema de funcionamento desse detector de etanol pode ser visto na figura.
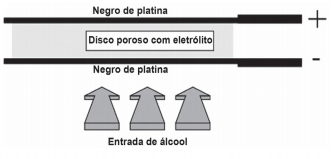
As reações eletroquímicas envolvidas no processo são:
Eletrodo A:
CH3CH2OH (g) → CH3CHO (g) + 2 H+ (aq) + 2 e-
Eletrodo B:
1/2 O2 (g) + 2 H+ (aq) + 2 e- → H2O (l)
BRAATHEN, P C. Hálito culpado: o princípio químico do bafômetro. Química nova na escola. São Paulo, n° 5, maio 1997 (adaptado).
No estudo das pilhas, empregam-se códigos e nomenclaturas próprias da Química, visando caracterizar os materiais, as reações e os processos envolvidos. Nesse contexto, a pilha que compõe o bafômetro apresenta o
O alumínio é um metal bastante versátil, pois, a partir dele, podem-se confeccionar materiais amplamente utilizados pela sociedade. A obtenção do alumínio ocorre a partir da bauxita, que é purificada e dissolvida em criolita fundida (Na3AlF6) e eletrolisada a cerca de 1 000 °C. Há liberação do gás dióxido de carbono (CO2), formado a partir da reação de um dos produtos da eletrólise com o material presente nos eletrodos. O ânodo é formado por barras de grafita submergidas na mistura fundida. O cátodo é uma caixa de ferro coberta de grafita. A reação global do processo é:
2 Al2 O3 (l) + 3 C (s) → 4 Al (l) + 3 CO2 (g)
Na etapa de obtenção do alumínio líquido, as reações que ocorrem no cátodo e ânodo são:
O ferro metálico é obtido em altos-fornos pela mistura do minério hematita (α-Fe2O3) contendo impurezas, coque (C) e calcário (CaCO3), sendo estes mantidos sob um fluxo de ar quente que leva à queima do coque, com a temperatura no alto-forno chegando próximo a 2 000 °C. As etapas caracterizam o processo em função da temperatura.
Entre 200 °C e 700 °C:
3 Fe2O3 + CO → 2 Fe3O4 + CO2
CaCO3 → CaO + CO2
Fe3O4 + CO → 3 FeO + CO2
Entre 700 °C e 1 200 °C:
C + CO2 → 2 CO
FeO + CO → Fe + CO2
Entre 1 200 °C e 2 000 °C:
Ferro impuro se funde
Formação de escória fundida (CaSiO3)
2 C + O2 → 2 CO
BROWN, T L.; LEMAY, H. E.; BURSTEN, B. E. Química: a ciência central. São Paulo: Pearson Education, 2005 (adaptado).
No processo de redução desse metal, o agente redutor é o
A invenção do LED azul, que permite a geração de outras cores para compor a luz branca, permitiu a construção de lâmpadas energeticamente mais eficientes e mais duráveis do que as incandescentes e fluorescentes. Em um experimento de laboratório, pretende-se associar duas pilhas em série para acender um LED azul que requer 3,6 volts para o seu funcionamento. Considere as semirreações de redução e seus respectivos potenciais mostrados no quadro.

Qual associação em série de pilhas fornece diferença de potencial, nas condições-padrão, suficiente para acender o LED azul?
A eletrólise é um processo não espontâneo de grande importância para a indústria química. Uma de suas aplicações é a obtenção do gás cloro e do hidróxido de sódio, a partir de uma solução aquosa de cloreto de sódio. Nesse procedimento, utiliza-se uma célula eletroquímica, como ilustrado.
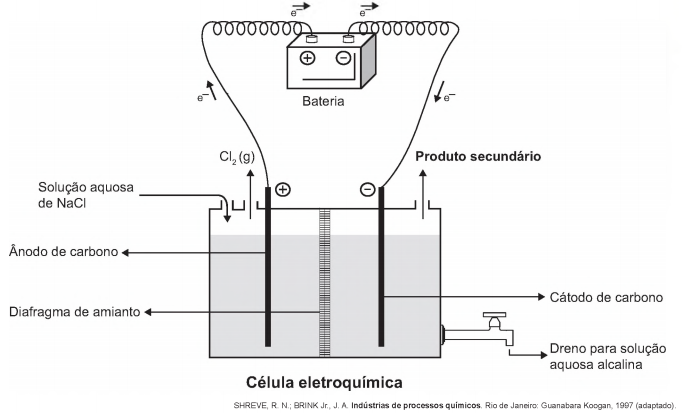
No processo eletrolítico ilustrado, o produto secundário obtido é o