Questões da Prova PUC-PR - 2012 - PUC - PR - Vestibular - Prova 1
Foram encontradas 70 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
I. CH4
II. CH3Cl
III. CH3OH
IV. HCOOH
Dado esse contexto, é CORRETO afirmar:
K2Cr2O7(aq.) + H2SO4(aq.) + C2H5OH(v) → C2H4O(g) + K2SO4(aq.) + Cr2(SO4)3(aq.) + H2O(l)
Analise as afirmativas referentes a esse processo químico.
I. A equação química corretamente balanceada tem como soma dos menores números inteiros 31.
II. A equação química corretamente balanceada tem como soma dos menores coeficientes inteiros 20.
III. O etanol é oxidado a aldeído acético e o dicromato
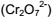 , amarelo-alaranjado, da
origem ao sulfato de íon crômio (III), verde.
, amarelo-alaranjado, da
origem ao sulfato de íon crômio (III), verde.
IV. O agente oxidante é o dicromato de potássio; portanto, ele contém o elemento que recebe elétrons, sofrendo redução.
V. O agente redutor é o ácido sulfúrico; portanto, contém o elemento que perde elétrons, sofrendo oxidação.
É correto o que se afirma APENAS em:
Peter Sorensen, bioquímico dinamarquês, apesar de importantes trabalhos com proteínas, enzimas e aminoácidos, ficou mais conhecido como o criador da escala de pH, usada para medir a acidez de uma solução, que varia de zero a 14. Para preparar uma solução com pH =12 foi adicionado hidróxido de - sódio em 50 mL de água a 25 °C. A quantidade em gramas de soda cáustica necessária é de:
Dados: Na=23u, O=16u, H=1u.
A velocidade de uma reação química depende de alguns fatores, dentre eles a concentração dos reagentes que interfere na rapidez de uma reação,porém a variação da concentração dos reagentes não é igual em todas as reações . A seguir propõe-se o seguinte mecanismo em duas etapas:
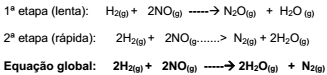
Mantendo a temperatura constante, ao duplicar a
concentração do H2(g) e reduzir à metade a
concentração do NO(g), a velocidade da reação, em
relação à velocidade inicial, torna-se: