Questões de Vestibular
Foram encontradas 839 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
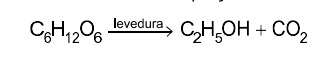
Leia o texto para responder às questões de 13 a 15. A produção de vinhos tem se desenvolvido nas últimas décadas em diversas regiões do Brasil. As características do vinho dependem de vários fatores, como condições de plantio (viticultura), processo de fermentação (vinificação) e compostos químicos participantes nessas etapas. Na viticultura, o óxido de cálcio (CaO) é usado para a correção do pH do solo, e o gesso agrícola ((CaSO4,2H2O é utilizado como fonte de cálcio e enxofre. Na vinificação, as uvas são prensadas e misturadas a leveduras, microrganismos que promovem a fermentação dos açúcares de acordo com a equação não balanceada:
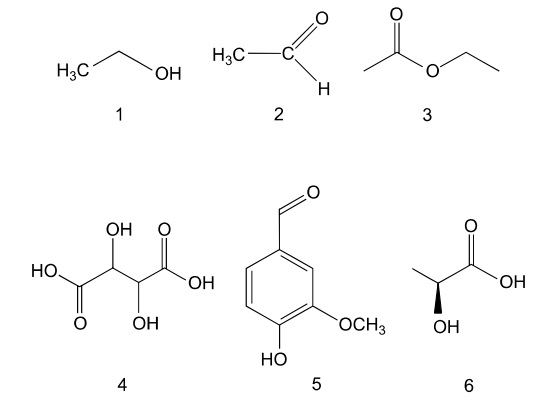
Durante o processo de vinificação, adiciona-se dióxido de enxofre (SO2,) para bloquear a ação de enzimas oxidantes. Alguns compostos orgânicos responsáveis pelo aroma e sabor do vinho estão representados pelas fórmulas estruturais de1 a 6.

O fenômeno climático das monções, que ocorre na Ásia, propicia a dispersão de poluentes que formam particulados, como o sulfato de amônio [(NH4)2SO4]. Esse composto é formado na atmosfera pela reação da amônia (NH3) com o dióxido de enxofre (SO2), de acordo com as equações:
SO2 (g)+ 1/2O2(g) → SO3 (g)
H2O (ℓ)+SO3(g) → H2SO4 (ℓ)
2NH3 (g) + H2SO4 (ℓ) → (NH4)2SO4 (s)
Considere os valores de entalpia-padrão de formação:
SO2 (g) 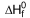 = -298 kJ/mol
= -298 kJ/mol
NH3 (g) 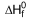 = -46 kJlmol
= -46 kJlmol
H2O (ℓ) 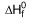 = -286 kJ/mol
= -286 kJ/mol
(NH4)2SO4 (s) 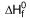 = -1179 kJ/mol
= -1179 kJ/mol
Com base nas informações apresentadas, pode-se afirmar
que a entalpia-padrão de reação de formação de 1 mol de
sulfato de amônio é
A chegada do homem à Lua, há 50 anos, possibilitou a coleta das rochas lunares, cuja análise permititu datar a idade do satélite natural da Terra com maior precisão. A técnica utilizada consistiu em determinar a proporção das quantidades do radioisótopo háfnio-182 e do isótopo estável tungstênio-182 presentes nessas rochas lunares.
O processo de decaimento radioativo do háfnio-182 apresenta uma etapa intermediária, na qual se forma o radioisótopo instável tântalo-182 que, por sua vez, decai para o tungstênio-182, de acordo com a equação:
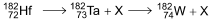
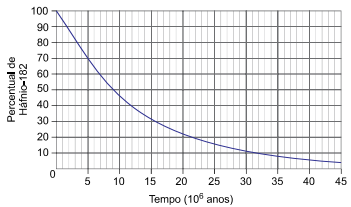
O decaimento radioativo do háfnio-182 resultando no tungstênio-182 em função do tempo ocorre de acordo com a curva apresentada no gráfico.
A emissão radioativa representada pela letra X na equação
de decaimento do háfnio-182 e a meia-vida desse radioisótopo em 106 anos são
Bicarbonato de sódio é utilizado como medicamento antiácido. Em presença de ácido, esse composto reage de acordo com a equação química a seguir:
NaHCO3 + H+ → Na+ + CO2 + H2O
Na reação completa de 16,8 g de NaHCO3 , a massa, em gramas, de CO2 produzida é igual a:
O radioisótopo 18F é empregado em exames de tomografia por emissão de pósitrons.
O número de nêutrons presentes nesse radioisótopo é igual a: