Questões de Vestibular
Foram encontradas 422 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Uma forma de reduzir a poluição atmosférica provocada pelo
gás dióxido de enxofre (SO2
), produzido em certas atividades
industriais, é realizar a lavagem dos gases de exaustão com
uma suspensão aquosa de cal hidratada [Ca(OH)2
]. Com
isso, ocorre uma reação química em que se formam sulfito de
cálcio (CaSO3) sólido e água (H2O) líquida, evitando a emissão do poluente para o ar.
Considerando que o volume molar de gás nas Condições Ambiente de Temperatura e Pressão (CATP) é igual a 25 L/mol, para cada 1,2 kg de sulfito de cálcio formado, o volume de dióxido de enxofre, medido nessas condições, que deixa de ser emitido para a atmosfera é de
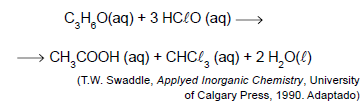
Considerando-se o tratamento de 1 m3 de água contaminada com acetona na concentração 5,8 mg/L, a quantidade máxima, em mol, de ácido hipocloroso que poderá ser consumida na reação com a acetona é igual a
Assinale a alternativa que apresenta o número atômico do elemento representado por X.
v H2S + w Br2 + x H2O → y H2SO4 + z HBr
A soma dos coeficientes estequiométricos (v, w, x, y e z) após o balanceamento da equação é igual a:
Dado: massa molecular do metano = 16 g.mol-1.
Com base nos dados fornecidos, a fórmula da molécula e o símbolo dos elementos citados são, respectivamente:

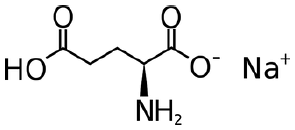
Se 0,1 g de glutamato monossódico for adicionado em um produto alimentício, a massa em miligramas de sódio proveniente desse sal será, aproximadamente:
Considerando a massa molar do mercúrio 201 g/mol e a constante de Avogadro 6,0 × 1023/mol, a quantidade de átomos de mercúrio por grama de fio de cabelo tolerada pela OMS é de, aproximadamente:
A produção da alumina a partir da bauxita, minério de alumínio, envolve uma série de etapas. Entre elas está a calcinação, na qual ocorre a seguinte reação:
Al(OH)3 ----> Al2 O3 + H2O
O balanceamento correto dessa reação, com os menores números inteiros, é dado, respectivamente, por:
Em motores de foguetes, ocorre a seguinte reação de hidrazina com peróxido de hidrogênio:
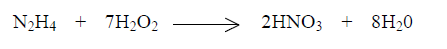
Para a produção de 630,1 gramas de ácido nítrico, são necessários quantos mols de hidrazina (N2H4)?
Pode-se concluir corretamente que, na combustão completa de 1 mol desse hidrocarboneto, as quantidades de matéria, e CO2 e de H2O produzidas são, em mol, respectivamente, iguais a
Observe a reação abaixo, que representa a adição de uma solução de permanganato de potássio em uma solução de ácido clorídrico.
KMnO4(aq) + HCI(aq) → KCI(aq) + MnCI2(aq) + CI2(g) + H2O(I)
O coeficiente estequiométrico do ácido clorídrico
da reação balanceada é
Os cosméticos, como batons e rímeis, buscam realçar o encanto da beleza. Porém, o uso desses produtos pode, também, causar desencantamento em função dos constituintes químicos tóxicos que possuem. Em batons, pode haver presença de cádmio, chumbo, arsênio e alumínio. A FDA (Food and Drug Administration) e a ANVISA (Agência Nacional de Vigilância Sanitária) preconizam limites máximos de metais apenas para corantes orgânicos artificiais utilizados como matéria-prima na fabricação de cosméticos.
Considerando que um determinado batom possua concentração de chumbo igual a 1,0 mg Kg−1 e que a estimativa máxima de utilização deste cosmético ao longo do dia seja de 100 mg, assinale a alternativa que representa, correta e aproximadamente, o número de átomos de chumbo em contato com os lábios ao longo de um dia.
Dados:
Massa molar de chumbo = 207 g mol−1
Constante de Avogadro = 6,0 x 1023 mol−1
A glicose, importante açúcar na alimentação de muitos seres vivos, possui fórmula igual a C6 H12O6 .
Sobre a glicose, é possível AFIRMAR que:
Um grupo de alunos do curso de Química, ao entrar no laboratório para uma atividade, deparou-se com alguns recipientes não rotulados, embora todos contivessem uma substância líquida e incolor.
Considerando as substâncias, os acadêmicos determinaram as seguintes propriedades para reconhecimento: 1) massa, 2) volume, 3) ponto de ebulição, 4) densidade.
Com base nestas informações, indique quais propriedades possibilitaram aos acadêmicos a identificação das substâncias:
Leia o texto para responder a questão.

Voando na altitude de cruzeiro com uma velocidade média, em relação ao solo, de 800 km/h, um Boeing 737-800 percorreu uma distância de 2400 km.
Considere que:
• o QAV é constituído por hidrocarbonetos cujas cadeias
carbônicas contêm, em média, 12 átomos de carbono
e 26 átomos de hidrogênio, apresentando massa molar
média de 170 g/mol;
• a combustão do QAV na altitude de cruzeiro é completa.
De acordo com os dados, a massa de CO2
(g) gerada pela
combustão do QAV na distância percorrida pelo avião foi próxima de
Dentre os diversos agentes tóxicos, o arsênio é historicamente famoso por se tratar de uma substância muito utilizada na Idade Média para assassinatos com interesses políticos. Podemos até dizer que a morte por arsênio foi a precursora da química forense. Na época, havia uma epidemia desses casos, cuja prevenção era muito difícil, uma vez que óxido de arsênio, As2O3, é um sólido branco, solúvel, sem cheiro e gosto, sendo dificilmente detectado por análises químicas convencionais, o que lhe deu o status de óxido do crime perfeito. Além disso, o óxido de arsênio (III) é um composto muito utilizado na fabricação de vidros e inseticidas. Ele é convertido em ácido arsenioso (H3AsO3 ) em contato com água. Um método para se determinar o teor de arsênio é por meio de oxidação com permanganato de potássio e ácido sulfúrico, conforme equação não balanceada a seguir:
H3AsO3 + KMnO4 + H2SO4 → H3AsO4 + K2SO4 + MnSO4 + H2O
Sabendo que para 2,000 g de amostra foram gastos
10,00 mL de uma solução de KMnO4 0,05 M, em que ocorre a reação acima completa, em meio de ácido sulfúrico, o
percentual de arsênio na amostra é:
O cinamaldeído é um dos principais compostos que dão o sabor e o aroma da canela. Quando exposto ao ar, oxida conforme a equação balanceada:
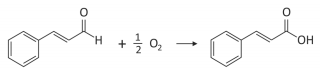
Uma amostra de 19,80 g desse composto puro foi exposta ao ar por 74 dias e depois pesada novamente, sendo que a massa final aumentou em 1,20 g. A porcentagem desse composto que foi oxidada no período foi de
Note e adote:
Massas molares (g/mol):
Cinamaldeído = 132; O2 = 32
Considere que não houve perda de cinamaldeído ou do produto de oxidação por evaporação.

