Questões de Vestibular
Foram encontradas 1.845 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!

Considere o comportamento dos gases hidrogênio e cloro, respectivamente, em seus balões, nas mesmas condições de temperatura e de pressão.
As informações da imagem retratam o princípio que corresponde à lei de
https://www.todamateria.com.br/tabela-periodica. Acessado em 12/10/2020.
Considerando os metais alcalinos terrosos (grupo 2 A da Tabela Periódica), é possível afirmar que seus elétrons da camada de valência estão
Referência Bibliográfica: https://www.minhavida.com.br/saude/temas/azia. (adaptado).
Os produtos finais gerados a partir da interação entre o bicarbonato de sódio e o HCl estomacal são componentes inorgânicos, quantitativamente identificados pelas seguintes funções inorgânicas:
Texto base para a questão.
A Tiquira é um destilado de mandioca muito popular no Maranhão. Alguns consideram a Tiquira a verdadeira aguardente brasileira por ser feita da mandioca, uma planta nativa.
A aguardente tiquira – destilado produzido a partir do mosto fermentado de mandioca, originalmente incolor, adquire uma cor azulada, em razão da adição de folhas ou de flores de tangerina durante o processo de destilação. A obtenção do álcool, no processo de fermentação, ocorre conforme a reação química a seguir:
C6H12O6 → CO2 + CH3CH2OH
glicose etanol
Alguns produtores informais adicionam um corante chamado violeta de metila, conforme estrutura representada a seguir, que garante um vívido azul-arroxeado à bebida. Na Química, essa substância, é utilizada como um indicador para o intervalo de pH com valores de 0 a 1,6, quando apresenta uma coloração amarelada.
Considere os seguintes dados: C = 12 g.mol -1, H = 1 g.mol -1 e O = 16 g.mol -1.
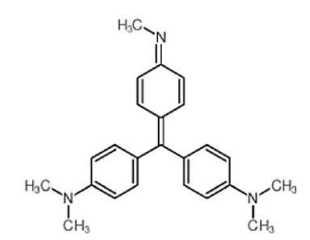
Estrutura química do indicador violeta de metila
Texto base para a questão.
A Tiquira é um destilado de mandioca muito popular no Maranhão. Alguns consideram a Tiquira a verdadeira aguardente brasileira por ser feita da mandioca, uma planta nativa.
A aguardente tiquira – destilado produzido a partir do mosto fermentado de mandioca, originalmente incolor, adquire uma cor azulada, em razão da adição de folhas ou de flores de tangerina durante o processo de destilação. A obtenção do álcool, no processo de fermentação, ocorre conforme a reação química a seguir:
C6H12O6 → CO2 + CH3CH2OH
glicose etanol
Alguns produtores informais adicionam um corante chamado violeta de metila, conforme estrutura representada a seguir, que garante um vívido azul-arroxeado à bebida. Na Química, essa substância, é utilizada como um indicador para o intervalo de pH com valores de 0 a 1,6, quando apresenta uma coloração amarelada.
Considere os seguintes dados: C = 12 g.mol -1, H = 1 g.mol -1 e O = 16 g.mol -1.

Estrutura química do indicador violeta de metila